题目内容
【题目】碳酸亚铁(FeCO3)是菱铁矿的主要成分,将其隔绝空气加热到200 ℃开始分解为FeO和CO2,若将其在空气中高温煅烧则生成Fe2O3。
(1)已知25 ℃、101 kPa时:
①C(s)+O2(g)=CO2(g) ΔH=-393 kJ·mol-1
②铁及其化合物反应的焓变示意图如图:
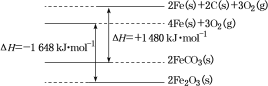
请写出FeCO3在空气中煅烧生成Fe2O3的热化学方程式:___________。
(2)据报道,一定条件下Fe2O3可被甲烷还原为“纳米级”的金属铁。其化学方程式为Fe2O3(s)+3CH4(g)![]() 2Fe(s)+3CO(g)+6H2(g) ΔH
2Fe(s)+3CO(g)+6H2(g) ΔH
①反应在3 L的密闭容器中进行,2 min后达到平衡,测得Fe2O3在反应中质量减少4.8 g,则该段时间内用H2表示该反应的平均反应速率为________________。
②将一定量的Fe2O3(s)和CH4(g )置于恒温恒容密闭容器中,在一定条件下反应,能说明反应达到平衡状态的是____________。
A CO和H2的物质的量之比为1∶2
B 混合气体的密度不再改变
C 铁的物质的量不再改变
D v正(CO)=2v逆(H2)
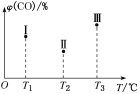
③在容积均为V L的Ⅰ、Ⅱ、Ⅲ三个相同的密闭容器中加入足量“纳米级”的金属铁,然后分别充入a mol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时,CO的体积分数如图所示,此时Ⅰ、Ⅱ、Ⅲ三个容器中一定处于化学平衡状态的是________;上述反应的ΔH________0(填“大于”或“小于”)。
(3)Fe2O3用CO还原焙烧的过程中,反应物、生成物和温度之间的关系如图所示。
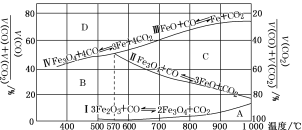
(图中Ⅰ、Ⅱ、Ⅲ、Ⅳ四条曲线是四个化学反应平衡时的气相组成对温度作图得到的;A、B、C、D四个区域分别是Fe2O3、Fe3O4、FeO、Fe稳定存在的区域)
若在800 ℃,混合气体中CO2体积分数为40%的条件下,Fe2O3用CO还原焙烧,写出反应的化学方程式:__________。
(4)Fe2O3还可以用来制备FeCl3,通过控制条件FeCl3可生成聚合物,其离子方程式为xFe3++yH2O![]() Fex(OH)
Fex(OH)![]() +yH+。下列措施不能使平衡正向移动的是________(填字母)。
+yH+。下列措施不能使平衡正向移动的是________(填字母)。
A 加水稀释 B 加入少量铁粉
C 升温 D 加入少量Na2CO3
【答案】4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)ΔH=-260 kJ·mol-1 0.03 mol·L-1·min-1 BC Ⅲ 大于 Fe2O3+CO![]() 2FeO+CO2 B
2FeO+CO2 B
【解析】
(1)图1分析书写热化学方程式,结合C(s)+O2(g)=CO2(g)△H=-393kJmol-1和盖斯定律计算得到FeCO3在空气中煅烧生成Fe2O3的热化学方程式;
(2)①2min后达到平衡,测得Fe2O3在反应中质量减少4.8g,依据化学方程式反应前后质量变化计算生成氢气的物质的量,根据反应速率概念计算得到氢气的反应速率;
②反应达到平衡状态时,正逆反应速率相等,各组分浓度保持不变,据此分析;
③2Fe(s)+3CO(g)+6H2(g)═Fe2O3(s)+3CH4(g),根据图2中Ⅰ、Ⅱ、Ⅲ图象,CO百分含量,由小到大,Ⅱ<Ⅰ<Ⅲ,结合化学平衡移动分析解答;根据温度对平衡的影响来判断,升高温度平衡逆向移动,CO的转化率减小,据此判断Fe2O3(s)+3CH4(g)═2Fe(s)+3CO(g)+6H2(g)△H大小;
(3)800℃时,混合气体中CO2体积分数为40%时,图象分析可知Fe2O3用CO还原得到氧化亚铁和一氧化碳;
(4)A.加水稀释,则水解平衡正向移动;
B.固体不能影响化学平衡;
C.控制条件使平衡正向移动,水解为吸热反应,所以升温平衡正向移动;
D.加入碳酸钠,则消耗氢离子,平衡正向移动。
(1)由铁及其化合物反应的焓变示意图可推知
①4Fe(s)+3O2(g)=2Fe2O3 ΔH1=-1648 kJ·mol-1
②2FeCO3(s)=2Fe(s)+2C(s)+3O2(g)ΔH2=+1480 kJ·mol-1
③C(s)+O2(g)=CO2(g) ΔH3=-393 kJ·mol-1
则在空气中煅烧FeCO3生成Fe2O3的焓变ΔH=2×ΔH2+ΔH1+4×ΔH3=2×1480 kJ·mol-1+(-1648 kJ·mol-1)+4×(-393 kJ·mol-1)=-260 kJ·mol-1,则热化学方程式为4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)ΔH=-260 kJ·mol-1;
故答案为:4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)ΔH=-260 kJ·mol-1;
(2)①测得Fe2O3在反应中减少的质量为4.8 g,则反应的n(Fe2O3)=![]() =0.03 mol,根据反应方程式得n(H2)=6n(Fe2O3)=6×0.03 mol=0.18 mol,则用H2表示的反应速率为v(H2)=
=0.03 mol,根据反应方程式得n(H2)=6n(Fe2O3)=6×0.03 mol=0.18 mol,则用H2表示的反应速率为v(H2)=![]() =0.03 mol·L-1·min-1;
=0.03 mol·L-1·min-1;
故答案为:0.03 mol·L-1·min-1;
②A.因为反应开始时,无CO和H2,随着反应的进行,CO和H2的物质的量之比一直为1∶2,不能说明反应达到平衡状态,故A错误;
B.该反应有固体参加,反应前后气体的质量有变化,又因为容器恒容,所以当混合气体的密度不变时,反应达到平衡状态,故B正确;
C.铁为反应物,当其质量不再改变时,反应达到平衡状态,故C正确;
D.当2v正(CO)=v逆(H2)时,反应达到平衡状态,故D错误;
综上所述,答案为BC;
③由题图可知,T1中的状态转变为T2中的状态,CO的体积分数减小,说明反应正向进行,所以状态Ⅰ未达到平衡状态;T2中的状态转变为T3中的状态,CO的体积分数增加,说明反应逆向移动,说明Ⅱ可能达到平衡状态,一定达到平衡状态的是状态Ⅲ;T3时温度最高,CO的体积分数增大,所以2Fe(s)+3CO(g)+6H2(g)=Fe2O3(s)+3CH4(g)的正反应为放热反应,则逆反应的ΔH大于0,故答案为:Ⅲ;大于;
(3)800℃时,混合气体中二氧化碳的体积分数为40%时,由图可知,在C区,此时为氧化亚铁的稳定区域,所以产物为氧化亚铁,Fe2O3用CO还原焙烧得到氧化亚铁和二氧化碳,反应的方程式为:Fe2O3+CO![]() 2FeO+CO2,故答案为:Fe2O3+CO
2FeO+CO2,故答案为:Fe2O3+CO![]() 2FeO+CO2;
2FeO+CO2;
(4)A.水为反应物,加水稀释平衡会正向移动,故A正确;
B.加入铁粉,反应物Fe3+的量减少,平衡会向逆向移动,故B错误;
C.该反应为吸热反应,所以升高温度,平衡会正向移动,故C正确;
D.加入少量Na2CO3,碳酸钠会消耗氢离子,使氢离子的浓度减小,平衡正向移动,故D正确;
综上所述,答案为B。

 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案【题目】下列实验方案能达到相应实验目的的是( )
选项 | 实验目的 | 实验方案 |
A | 检验溴乙烷中的溴原子 | 加入 |
B | 检验溴乙烷发生了消去反应 | 加 |
C | 除去溴苯中的溴 | 用 |
D | 确定乙醇分子的结构 | 通过质谱仪进行质谱分析 |
A.AB.BC.CD.D