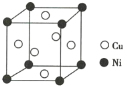
题目内容
【题目】硼及其化合物在耐高温合金工业、催化剂制造、高能燃料等方面有广泛应用。
(1)硼原子的价电子排布图为____________。
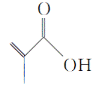
(2)B2H6是一种高能燃料,它与Cl2反应生成的BCl3可用于半导体掺杂工艺及高纯硅制造。由第二周期元素组成的与BCl3互为等电子体的阴离子为________。
(3)氮硼烷化合物(H2N→BH2)和Ti(BH4)3均为广受关注的新型储氢材料。
①B与N的第一电离能:B__________N(填“>”“<”或“=”,下同)。H2N―→BH2中B原子的杂化类型为________。
②Ti(BH4)3由TiCl3和LiBH4反应制得。BH4-的立体构型是________;写出制备反应的化学方程式:____________。
(4)磷化硼(BP)是受到高度关注的耐磨材料,它可用作金属表面的保护层。如图为磷化硼晶胞。
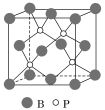
①磷化硼晶体属于______________晶体(填晶体类型),____________(填“是”或“否”)含有配位键。
②晶体中P原子的配位数为____________。
③已知BP的晶胞边长为a nm,NA为阿伏加德罗常数的数值,则磷化硼晶体的密度为____________g·cm-3(用含a、NA的式子表示)。
【答案】![]() CO32-或NO3- < sp2 正四面体 TiCl3+3LiBH4=Ti(BH4)3+3LiCl 原子 是 4
CO32-或NO3- < sp2 正四面体 TiCl3+3LiBH4=Ti(BH4)3+3LiCl 原子 是 4 ![]()
【解析】
(1)硼处于第二周期ⅢA族,其2s、2p电子为其价电子;
(2)等电子体原子个数相等、价电子数相等;
(3)①根据元素周期律,同周期元素从左向右第一电离能逐渐增大;H2N →BH2中N原子的价层电子对数为3,据此判断杂化类型;
②根据BH4-中B原子的杂化方式可知其立体构型;根据元素守恒书写化学方程式;
(4)①在磷化硼晶体中,磷和硼原子之间通过共价键相互作用,结合性质可知其晶体类型,硼最外层有3个电子,但根据晶胞结构可知,每个硼和磷周围都有4个共价键,所以磷原子含有孤电子对,硼原子含有空轨道,它们之间存在配位;
②根据晶的结构图可知,每个磷原子周围有4个硼原子;
③BP的晶胞边长为anm=a×10-7cm,其体积为(a×10-7cm)3,根据晶胞图可知,每个晶胞中含有B原子数为4,P原子数为8×![]() +6×
+6×![]() =4,根据ρ=
=4,根据ρ=![]() 计算。
计算。
(1)硼是五号元素,价电子数为3,原子的价电子排布图为![]() ,故答案为:
,故答案为:![]() ;
;
(2)原子总数相同,价电子总数也相同的粒子互为等电子体,所以由第二周期元素组成的与BCl3互为等电子体的阴离子为![]() 或
或![]() ,故答案为:
,故答案为:![]() 或
或![]() ;
;
(3)①根据元素周期律,同周期元素从左到右第一电离能逐渐增大,所以B的第一电离能小于N的第一电离能;H2N→BH2中B原子的价层电子对数为![]() ,所以B原子杂化类型为sp2;故答案为:<;sp2;
,所以B原子杂化类型为sp2;故答案为:<;sp2;
②![]() 中B原子的价层电子对数为
中B原子的价层电子对数为![]() ,所以杂化方式为sp3杂化,则
,所以杂化方式为sp3杂化,则![]() 的立体构型为正四面体,Ti(BH4)3由TiCl3和LiBH4反应制得,反应的化学方程式为TiCl3+3LiBH4=Ti(BH4)3+3LiCl,故答案为:正四面体;TiCl3+3LiBH4=Ti(BH4)3+3LiCl;
的立体构型为正四面体,Ti(BH4)3由TiCl3和LiBH4反应制得,反应的化学方程式为TiCl3+3LiBH4=Ti(BH4)3+3LiCl,故答案为:正四面体;TiCl3+3LiBH4=Ti(BH4)3+3LiCl;
(4)①在磷化硼晶体中,磷和硼原子之间通过共价键相互作用,结合耐磨的性质可知其晶体类型为原子晶体;硼原子最外层有3个电子,但根据晶胞结构可知,每个硼周围都有4个共价键,所以存在配位键,故答案为:原子;是;
②根据晶胞结构可知,每个磷原子周围有4个硼原子,所以配位数为4,故答案为:4;
③BP的晶胞边长为a nm=a×10-7 cm,其体积为(a×10-7 cm)3,根据晶胞结构可知,每个晶胞中含有P原子数为4,B原子数为8×![]()
![]() =4,所以磷化硼晶体的密度为
=4,所以磷化硼晶体的密度为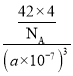 g·cm-3=
g·cm-3=![]() g·cm-3,故答案为:
g·cm-3,故答案为:![]() 。
。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案【题目】下列实验操作能产生对应实验现象的是
实验操作 | 实验现象 | |
A | 用玻璃棒蘸取氯化铵溶液,点在红色石蕊试纸上 | 试纸变蓝色 |
B | 向盛有 K2Cr2O7 溶液的试管中滴加浓硫酸,充分振荡 | 溶液由橙黄色逐渐变为黄色 |
C | 向 FeCl3 溶液中加入 KI 溶液,再加入苯,充分振荡,静置 | 溶液分层,上层呈紫色 |
D | 向蔗糖在硫酸催化下水解后的溶液中,加入新制 氢氧化铜悬浊液并加热 | 出现砖红色沉淀 |
A.AB.BC.CD.D