题目内容
【题目】下列说法正确的是
A. 乙烯通过聚合反应可得到高分子材料
B. 聚丙烯的结构单元是—CH2-CH2-CH2—
C. 碳纤维属于合成有机高分子化合物
D. 聚乙烯塑料的老化是因为发生了加成反应
【答案】A
【解析】A.乙烯含有碳碳双键可发生加聚反应;
B.根据丙烯的结构简式判断;
C.碳纤维是一种含碳量在95%以上的高强度、高模量纤维的新型纤维材料;
D.聚乙烯中不存在碳碳双键。
A. 乙烯含有碳碳双键,通过聚合反应即加聚反应可得到高分子材料聚乙烯,A正确;
B. 丙烯的结构简式为CH2=CHCH3,则聚丙烯的结构单元是 ,B错误;
,B错误;
C. 碳纤维不属于合成有机高分子化合物,而是一种含碳量在95%以上的高强度、高模量纤维的新型纤维材料,C错误;
D. 乙烯发生加聚反应生成聚乙烯,聚乙烯中不存在碳碳双键,所以聚乙烯塑料的老化不是因为发生了加成反应,而是被氧化导致,D错误。
答案选A。

【题目】某校学习小组的同学拟用工业废铁屑(主要成分为Fe,还含有少量FeS、Fe3P等)制备FeSO4·7H2O,并探究FeSO4·7H2O高温分解的产物。
I.制备实验步骤如下:
①称取一定量的废铁屑,用热的碳酸钠溶液浸泡,再用蒸馏水洗涤。
②将处理后的废铁屑放入锥形瓶中,加入适量3mol/L的硫酸,连接好装置(如图)后水浴加热至反应完全。
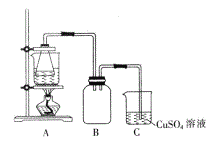
③依据现象停止加热,趁热过滤,向滤液中补加少量硫酸。
④将滤液冷却、结晶、过滤、洗涤。
回答下列问题
(1)步骤①称量5.6g废铁屑时,若砝码与物品的位置放反了,则称得的废铁屑的质量会____ (填“增大”“减小”或“不变”)。
(2)步骤②中需控制硫酸的用量,使铁粉过量,其目的是_____________。
(3)装置C的作用是_____________。
(4)步骤④中洗涤时所用的洗涤剂最好是_____________。
A.稀硝酸 B.无水乙醇 C.苯
(5)测定产品的纯度:
称取mg产品,放入锥形瓶中,用经煮沸过且冷却的蒸馏水和稀硫酸溶解,然后cmol/L的KMnO4标准溶液滴定,消耗VmLKMnO4标准溶液。
滴定过程中发生反应的离子方程式为________;产品的纯度为_________(列出计算表达式即可)。
Ⅱ.探究FeSO4·7H2O高温分解的产物的实验装置及步骤如下,请完成相关填空:
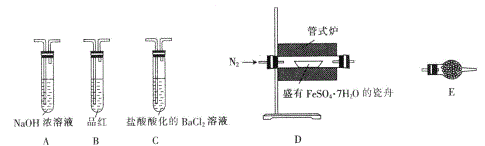
操作步骤 | 实验现象 | 解释原因 |
组装好仪器,先充入氮气,再加热管式炉至700℃一段时间 | 试管E中的白色固体变蓝 | 分解得到的产物中含水蒸气 |
气体产物经过试管B时 | 品红溶液褪色 | (6)_____________ |
气体产物经过试管C时 | 试管C中出现白色沉淀 | (7)C中反应的化学方程式为_____________ |
将瓷舟中反应后的固体溶于足量稀硫酸,再滴入几滴KSCN溶液 | (8)_____________ | (9)_____________ |
【题目】超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层.科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2 , 化学方程式如下:2NO+2CO2CO2+N2
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
C(NO)/molL﹣1 | 1.00×10﹣3 | 4.50×10﹣4 | 2.50×10﹣4 | 1.50×10﹣4 | 1.00×10﹣4 | 1.00×10﹣4 |
C(CO)/molL﹣1 | 3.60×10﹣3 | 3.05×10﹣3 | 2.85×10﹣3 | 2.75×10﹣3 | 2.70×10﹣3 | 2.70×10﹣3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)若1molNO和1molCO的总能量比1molCO2和0.5molN2的总能量大,则上述反应的△H0(填写“>”、“<”、“=”.)
(2)前2s内的平均反应速率v(N2)= .
(3)计算4s时NO的转化率 .
(4)下列措施能提高NO和CO转变成CO2和N2的反应速率的是 .
A.选用更有效的催化剂
B.升高反应体系的温度
C.降低反应体系的温度
D.缩小容器的体积
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.
实验编号 | T/℃ | NO初始浓度/molL﹣1 | CO初始浓度/molL﹣1 | 催化剂的比表面积/m2g﹣1 |
Ⅰ | 280 | 1.20×10﹣3 | 5.80×10﹣3 | 82 |
Ⅱ | 124 | |||
Ⅲ | 350 | 124 |
①请在上表格中填入剩余的实验条件数据.
②请在给出的坐标图中,画出上表中的Ⅰ、Ⅱ两个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线是实验编号.
【题目】下列图表中a、b、c表示对应装置的仪器中加入的试剂,可制取、净化、收集的气体是
选项 | a | b | c | 气体 | 装置 |
A | 浓氨水 | 生石灰 | 浓硫酸 | NH3 |
|
B | 浓H2SO4 | 铜屑 | NaOH溶液 | SO2 | |
C | 稀HNO3 | 铜屑 | H2O | NO | |
D | 稀盐酸 | 碳酸钙 | 饱和NaHCO3溶液 | CO2 |
A. A B. B C. C D. D




