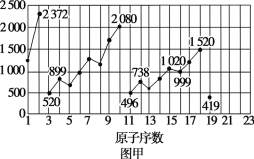
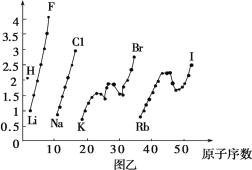
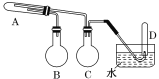
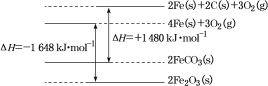
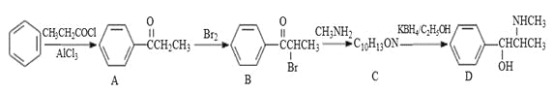
题目内容
【题目】a、b、c、d、e、f为元素周期表前四周期元素,且原子序数依次增大。a原子核内无中子;在考古行业中,元素b的一种核素常用来鉴定一些文物的年代;d原子核外电子有8种不同的运动状态;e为第四周期元素,其基态原子的价电子排布式中成对电子的电子对数与单电子数相等,且每个原子轨道中都有电子;f元素的基态原子最外能层只有1个电子,且其他能层均已充满电子。回答下列问题:
(1)六种元素中电负性最大的是__(填元素符号),其中e原子的价电子排布式为__。
(2)b有多种同素异形体,其中硬度最大的是___(填名称);写出一种属于分子晶体的b的同素异形体的化学式__。
(3)a、c形成的简单分子的化学式为___,分子中c原子的杂化类型为__,分子立体构型为___。
(4)六种元素中其中有两种元素形成的化合物___(填化学式)与c的单质互为等电子体。
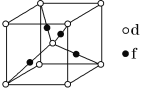
(5)元素d与f形成的一种化合物的晶胞结构如图所示,其中黑球在两个白球连线的中点。该化合物的化学式为__;若相邻d原子和f原子间的距离为acm,阿伏加德罗常数的值为NA,则该晶体的密度为__g·cm-3(用含a、NA的式子表示)。
【答案】O 3d74s2 金刚石 C60 NH3 sp3杂化 三角锥形 CO Cu2O 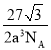
【解析】
a、b、c、d、e、f为元素周期表前四周期元素,且原子序数依次增大;a原子核内无中子,则a为H元素;元素b的的一种核素在考古时常用来鉴定一些文物的年代,则b为C元素;d原子核外电子有8种不同的运动状态,则d为氧元素,c为N元素;e为第四周期元素,其基态原子的价电子排布式中成对电子的电子对数与单电子数相等,且每个原子轨道中都有电子,则其价电子排布式为3d74s2,e为Co元素;f元素的基态原子最外能层只有一个电子,其它能层均已充满,则F原子外围电子排布为3d104s1,则f为铜元素,据此分析解题。
由分析可知a、b、c、d、e、f分别为H、C、N、O、Co、Cu元素;
(1)元素的非金属性越强,电负性越大,而六种元素中O元素非金属性最强,则电负性最大的是O,其中e原子的核电荷数为27,其价电子排布式为3d74s2;
(2)C的单质有金刚石、石墨和C60等,其中金刚石的硬度最大;C60为分子晶体;
(3)a、c形成的简单分子为NH3,其分子中N原子周围有1对孤对电子和3对成键电子,故N原子的杂化类型为sp3杂化,NH3的立体构型为三角锥形;
(4)c的单质为N2,原子数为2,价电子总数为14,与CO为等电子体;
(5)元素d与f形成的一种化合物的晶胞结构如图所示,其中黑球在两个白球连线的中点。该化合物的化学式为__;若相邻d原子和f原子间的距离为acm,阿伏加德罗常数的值为NA,则该晶体的密度为__g·cm-3(用含a、NA的式子表示)。
题给晶胞中O的个数为8×![]() +1=2,Cu的个数为4,故其化学式为Cu2O;最近的Cu和O的距离是体对角线长的
+1=2,Cu的个数为4,故其化学式为Cu2O;最近的Cu和O的距离是体对角线长的![]() ,故体对角线的长度为4a cm,边长为
,故体对角线的长度为4a cm,边长为![]() a cm,该晶体的密度为
a cm,该晶体的密度为 g·cm-3=
g·cm-3=![]() g·cm-3。
g·cm-3。

【题目】下列实验操作能达到目的的是( )
选项 | 实验目的 | 实验操作 |
A | 配制100 g10%的NaOH溶液 | 称取10 gNaOH溶于90 g蒸馏水中 |
B | 验证“84消毒液”呈碱性 | 用pH试纸测量溶液的pH |
C | 检验溶液中是否含有Na+ | 用洁净的玻璃棒蘸取溶液灼烧,观察火焰颜色 |
D | 从溴水中获得溴单质 | 利用SO2将Br2吹出后,富集、还原、分离 |
A.AB.BC.CD.D