题目内容
14.根据热化学方程式:S(s)+O2(g)═SO2(g)△H=a kJ•mol-1(a=-297.2).分析下列说法,其中不正确的是( )| A. | S(s)在O2(g)中燃烧的反应是放热反应 | |
| B. | 16 g固体硫在空气中充分燃烧,可吸收148.6 kJ的热量 | |
| C. | 1 mol SO2(g)所具有的能量低于1 mol S(s)与1 mol O2(g)所具有的能量之和 | |
| D. | S(g)+O2(g)═SO2(g)△H=b kJ•mol-1,则a>b |
分析 A、焓变是负值属于放热反应;
B、依据热化学方程式计算分析判断;
C、依据反应是放热反应,结合能量守恒分析判断;
D、气态S比固态S所含能量高.
解答 解:A、S(s)+O2(g)═SO2(g)△H=a kJ•mol-1(a=-297.2),焓变是负值,S(s)在氧气中燃烧的反应是放热反应,故A正确;
B、S(s)+O2(g)═SO2(g)△H=a kJ•mol-1(a=-297.2),16g固体硫为0.5mol,在氧气中充分燃烧,可放出148.6kJ的热量,故B错误;
C、反应是放热反应,1mol SO2(g)所具有的能量低于1mol S(s)与1mol O2(g)所具有的能量之和,故C正确;
D、气态S比固态S所含能量高,所以气态S若使放热多,放热越多焓变越小,所以a>b,故D正确;
故选B.
点评 本题考查了热化学方程式书写方法,焓变分析判断,能量守恒分析应用,热化学方程式计算,掌握基础是关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.关于结构简式为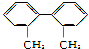 的烃的下列说法正确的是( )
的烃的下列说法正确的是( )
 的烃的下列说法正确的是( )
的烃的下列说法正确的是( )| A. | 分子中至少有6个碳原子共平面 | B. | 分子中至少有8个碳原子共平面 | ||
| C. | 分子中至少有9个碳原子共平面 | D. | 分子中至少有14个碳原子共平面 |
5.下列分子中,键的极性最强的是( )
| A. | PH3 | B. | H2S | C. | HBr | D. | HCl |
2.有机物A的结构简式如图,下列关于A的性质叙述中,错误的是( )


| A. | 不能发生水解反应 | |
| B. | A能与碳酸钠溶液反应 | |
| C. | A既能与羧酸反应,又能与醇反应 | |
| D. | A与氢氧化钠溶液完全反应时,两者物质的量之比是1:3 |
9.某溶液中含有HCO3-、CO32-、SO32-、Na+、NO3-五种离子.若向其中加入Na2O2充分反应后(溶液体积变化忽略不计),溶液中离子浓度保持不变的是( )
| A. | NO3- | B. | CO32-、NO3- | C. | SO32-、NO3- | D. | CO32-、NO3-、Na+ |
19.下列说法中正确的是( )
| A. | 如果找到合适的催化剂,就能够在不消耗能源的条件下从水中获得氢气 | |
| B. | 放热反应中反应物的总能量比生成物的总能量低 | |
| C. | 伴有能量变化的物质变化都是化学变化 | |
| D. | 吸热反应在不加热的条件下也能发生 |
3.下列说法中,错误的是( )
| A. | 人类目前所直接利用的能量大部分是由化学反应产生的 | |
| B. | 煤、石油、天然气是当今世界最重要的三种化石燃料 | |
| C. | 化学变化中的能量变化主要是由化学键变化引起的 | |
| D. | 化学反应中能量变化的大小与反应物的质量多少无关 |
 在一体积为10L的容器中,通入一定量的CO和H2O,850℃时发生反应:CO(g)+H2O(g)?CO2(g)+H2(g).CO和H2O浓度变化如图所示:
在一体积为10L的容器中,通入一定量的CO和H2O,850℃时发生反应:CO(g)+H2O(g)?CO2(g)+H2(g).CO和H2O浓度变化如图所示: