题目内容
9.某溶液中含有HCO3-、CO32-、SO32-、Na+、NO3-五种离子.若向其中加入Na2O2充分反应后(溶液体积变化忽略不计),溶液中离子浓度保持不变的是( )| A. | NO3- | B. | CO32-、NO3- | C. | SO32-、NO3- | D. | CO32-、NO3-、Na+ |
分析 Na2O2可与水反应生成NaOH,且过氧化钠具有强氧化性,具有还原性的离子或与OH-反应的离子不能大量共存;然后根据离子反应发生条件对各选项进行判断.
解答 解:Na2O2粉末加入溶液中,SO32-因被氧化而减少,因有NaOH生成,则HCO3-与之反应生成CO32-,使CO32-、Na+均增加,HCO3-减少,整个过程中只有NO3-浓度保持不变.
故选A.
点评 本题考查离子共存问题,侧重于过氧化钠的性质的考查,为高频考点,题目难度不大,注意把握物质的性质,学习中注意相关基础知识的积累.

练习册系列答案
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
19.下列化学式及结构式中,从成键情况看不合理的是( )
| A. | CH4Si: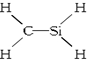 | B. | CH4S: | C. | CH2SeO: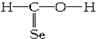 | D. | CH3N: |
20.关于下列图示装置的描述中,不正确的是( )
| A. | 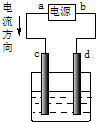 c为阳极,d为阴极 | |
| B. | 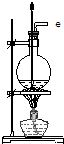 用于实验室蒸馏石油 | |
| C. | 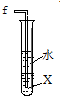 X为CCl4时,可用于吸收氯化氢气体,并防止倒吸 | |
| D. | 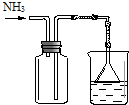 用于收集氨气及并进行尾气吸收 |
17.实验室用图所示的装置制取乙酸乙酯,下列说法正确的是( )
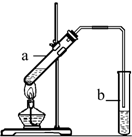

| A. | 向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸 | |
| B. | 用CH3CH218OH与乙酸反应制取乙酸乙酯,18O 存在于水中 | |
| C. | 试管b中的液体是饱和NaHCO3溶液 | |
| D. | 实验时加热试管a的目的之一是及时将乙酸乙酯蒸出,使平衡向生成乙酸乙酯的方向移动 |
14.根据热化学方程式:S(s)+O2(g)═SO2(g)△H=a kJ•mol-1(a=-297.2).分析下列说法,其中不正确的是( )
| A. | S(s)在O2(g)中燃烧的反应是放热反应 | |
| B. | 16 g固体硫在空气中充分燃烧,可吸收148.6 kJ的热量 | |
| C. | 1 mol SO2(g)所具有的能量低于1 mol S(s)与1 mol O2(g)所具有的能量之和 | |
| D. | S(g)+O2(g)═SO2(g)△H=b kJ•mol-1,则a>b |
1.镁和盐酸反应太剧烈,为了减缓反应速率而又不减少产生氢气的量,在盐酸中可加入( )
| A. | NaCl溶液 | B. | NaNO3溶液 | C. | Na2CO3溶液 | D. | CuSO4溶液 |
18.X、Y、Z、R是中学化学常见的4种主族元素,原子序数依次增大.Y在周期表前20号元素中原子半径最大;X、Y可以形成YX型离子化合物,且离子核外电子数相等;Z、R可以形成共价分子RZ,两原子最外层均达到8电子结构,R显+1价.回答下列问题:
(1)Y的单质与水反应的化学方程式是2K+2H2O=2KOH+H2↑.
(2)R元素在周期表中位于第戊周期ⅦA族.
(3)根据原子结构理论预测:按X、Z、R顺序,原子核外电子层数依次递增,原子半径逐渐增大,得电子能力逐渐减弱,非金属性逐渐减弱,所以X、Z、R三种元素的非金属性由强及弱的顺序是Cl>Br>I(填写元素符号).
(4)为了证明这一结论,甲同学设计了如下实验:
乙同学分析后认为:用甲同学的实验设计比较R、Z的非金属性不够严谨,你认为他的理由可能是实验I结束后Cl2可能剩余.
丙同学为了比较R、Z的非金属性,在甲同学方案的基础上补充设计了如下实验:
向Y、Z、R简单离子的混合溶液中,加入少许CCl4,滴加少量X单质的水溶液,振荡,观察CCl4层的颜色.
丙同学的设计依据是在含有I-、Br-离子溶液中加入少量Cl2,还原性强的物质先被氧化.
(1)Y的单质与水反应的化学方程式是2K+2H2O=2KOH+H2↑.
(2)R元素在周期表中位于第戊周期ⅦA族.
(3)根据原子结构理论预测:按X、Z、R顺序,原子核外电子层数依次递增,原子半径逐渐增大,得电子能力逐渐减弱,非金属性逐渐减弱,所以X、Z、R三种元素的非金属性由强及弱的顺序是Cl>Br>I(填写元素符号).
(4)为了证明这一结论,甲同学设计了如下实验:
| 序号 | 实验内容 | 实验现象 | 用离子方程式解释现象 |
| 实验Ⅰ | 向YZ的水溶液中,加入少许CCl4,逐滴滴加X单质的水溶液,振荡. | CCl4层颜色变成橙红色 | 发生反应的离子方程式是Cl2+2Br-=2Cl-+Br2. |
| 实验Ⅱ | 向上述溶液中加入少量YR的水溶液,振荡. | CCl4层颜色变成紫红色 | 发生反应的离子方程式是Br2+2I-=2Br-+I 2. |
丙同学为了比较R、Z的非金属性,在甲同学方案的基础上补充设计了如下实验:
向Y、Z、R简单离子的混合溶液中,加入少许CCl4,滴加少量X单质的水溶液,振荡,观察CCl4层的颜色.
丙同学的设计依据是在含有I-、Br-离子溶液中加入少量Cl2,还原性强的物质先被氧化.
19.含硒(Se)的保健品已开始进入市场.已知硒与氧同主族,与钾同周期,则下列关于硒的叙述中,正确的是( )
| A. | 原子序数为34 | B. | 氢化物比HBr稳定 | ||
| C. | 非金属性比硫强 | D. | 最高价氧化物的水化物显碱性 |
 不属于烃类的是④(填序号,下同),与①互为同系物的是②,与③互为同分异构体的是⑤.
不属于烃类的是④(填序号,下同),与①互为同系物的是②,与③互为同分异构体的是⑤.