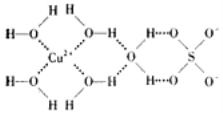
题目内容
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:
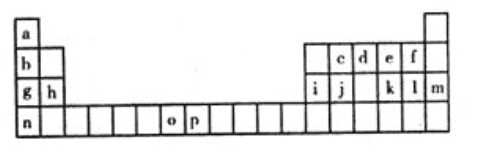
(1)写出元素k的基态原子的电子排布式________________________________,其原子核外有________个未成对电子。
(2)单质c在空气中充分燃烧的产物的分子构型为________ ,中心原子的杂化方式为_______,该分子含有________(填“极性键”或“非极性键”),该分子是________分子(填“极性”或“非极性”)。
(3)上述元素的最高价氧化物的水化物中,酸性最强的是___________________,碱性最的___________________(填化学式)。(每空1分)
(4)d的气态氢化物与d的最高价氧化物的水化物反应的离子方程式是:___________________________________________________________________________________________________________________________________。
(5)o、p两元素的部分电离能数据列于下表:比较两元素的I2、I3可知,气态o2+再失去一个电子比气p2+再失去一个电子困难。对此,你的解是__________________________________________________________________________。
元素 | o | P | |
电离能/kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
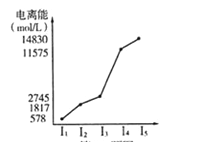
(6)短周期某主族元素的电离能情况如上图所示,则元素是上述周期表的__________元素(填元素符号)。
【答案】 1s22s22p63s23p4 2个 直线形 sp 极性键 非极性 HClO4 KOH NH3 + H+ =NH4+ Mn2+的3d轨道电子排布为半满状态,比较稳定 Al
【解析】根据元素周期表可知a为H元素、b为Li元素、c为C元素、d为N元素、e为O元素、f为F元素、g为Na元素、h为Mg元素、i为Al元素、j为Si元素、k为S元素、l为Cl元素、m为Ar元素、n为K元素、o为Mn元素、p为Fe元素;
(1)S元素的核电荷数为16,其基态原子的电子排布式为1s22s22p63s23p4,其原子核外p轨道上2个未成对电子;
(2)C原子价层电子对数=2+![]() =2,无孤对电子,中心原子的杂化方式为sp2,CO2分子构型为直线型,分子结构对称,正负电荷重心重合,为非极性分子;
=2,无孤对电子,中心原子的杂化方式为sp2,CO2分子构型为直线型,分子结构对称,正负电荷重心重合,为非极性分子;
(3)上述元素中非金属性F>Cl>S,F无正价,则最高价氧化物的水化物中酸性最强的是HClO4;K是最活泼的金属,则最高价氧化物的水化物中碱性最强的是KOH;
(4)NH3与HNO3生成NH4NO3,发生反应的离子方程式是NH3 + H+ =NH4+ ;
(5)p为Fe元素,o为Mn元素,Mn2+的3d轨道电子排布为半满状态较稳定,而Fe2+的3d轨道电子数为6,不是较稳定状态,所以气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难;
(6)根据表中所列的某主族元素的电离能可知,该元素原子最外层电子数为3,所以该元素为Al元素。

【题目】下表是A、B、C、D四种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色;②比例模型为 |
B | ①由C、H两种元素组成;②球棍模型为 |
C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与D反应生成相对分子质量为88的酯 |
D | ①由C、H、O三种元素组成;②球棍模型为 |
回答下列问题:
(1)A与溴的四氯化碳溶液反应的化学方程式为:___________________。
(2)B具有的性质是________(填序号)。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大
⑤与酸性KMnO4溶液和溴水反应褪色 ⑥任何条件下不与氢气反应
(3)B在50~60℃时,能与混酸(浓硫酸和浓硝酸的混合溶液)反应,该反应的反应类型是_______________,化学方程式为___________________。
(4)C与D反应生成有香味的物质的化学方程式为: _______________,该反应的反应类型是_______________。
(5)B与液溴及铁反应的化学方程式为:__________, 生成有机物的名称是________。
【题目】下列实验操作和现象对应的结论错误的是
选项 | 实验操作和现象 | 结论 |
A | 向溶液X中滴加BaCl2溶液,有白色沉淀生成 | 溶液X中可能含有SO42- |
B | 物质的量之比为2:3的稀硝酸和稀硫酸
| 反应结束后,锥形瓶中溶液的溶质是CuSO4,集气瓶中收集到的气体是NO |
C | 向1mL浓度均为0.05mol·L-1NaCl、NaI的混合溶液中滴加2滴0.01mol·L-1AgNO3溶液,振荡,沉淀是黄色 | Ksp(AgCl)<Ksp(AgI) |
D | 室温下,用pH试纸测得0.1mol·L-1 NaHSO3溶液的pH约为5 | HSO3-的电离程度大于其水解程度 |