题目内容
【题目】A、X、Y、Z、Q、R、T分别代表原子序数依次增大的短周期元素。元素A是原子半径最小的元素;X、Y、Z同周期且相邻,都是蛋白质的组成元素;X、R同族,Q与T原子的最外层电子数之和是R原子最外层电子数的2倍,T单质为淡黄色固体。U是d区元素,U2+的核外最高能级有2对成对电子。请回答下列问题:
(1)Y元素在周期表中的位置____________,位于周期表_____区;Q原子的核外电子排布式为________。
(2)X、Y、Z元素的第一电离能由大到小的顺序是________________。
(3)TZ3分子为________分子(填“极性”或“非极性”),YZ2-离子的VSEPR模型名称是________。(每空2分)
(4)Z和T的简单气态氢化物稳定性好的是_______(填化学式),原因是________________________________________________________________。
(5)A、X、Z、可形成分子式为A2XZ的有机物,则该化合物分子中B原子的轨道杂化类型是________;1mol该分子中含有π键的数目是________。
(6)通常情况下,U2+的溶液很稳定,它与YH3形成的配位数为6的配离子却不稳定,在空气中易被氧化为配位数不变的+3价配离子.该反应的离子方程式是________________________________________________________________________。
【答案】 第二周期第五主族 P 1s22s22p63s2 N﹥O﹥C 非极性 V形 H2O 氧原子半径小于硫原子,氧元素非金属性更强 sp 1mol 4[Co(NH3)6]2+ + O2 + 2H2O= 4[Co(NH3)6]3+ + 4OH
【解析】元素A是原子半径最小的元素,则A为H元素;X、Y、Z同周期且相邻,都是蛋白质的组成元素,则X为C、Y为N、Z为O;X、R同族,则R为Si;Q与T原子的最外层电子数之和与是R原子最外层电子数的2倍,则Q、T原子最外层电子数之和为8,二者原子序数均大于氧,T单质为淡黄色固体,则T为S元素,Q为Mg;U是d区元素,U2+的核外最高能级有2对成对电子,原子外围电子排布为3d74s2,故U为Co;
(1)Y为N元素,核电荷数为7,在元素周期表中位于第二周期第ⅤA族,外围电子排布式为2s22p3,电子最后填充p能级,属于p区元素;Q为Mg,原子的核外电子排布式为1s22s22p63s2;
(2)C、N、O是同周期元素,核电荷数增大,第一电离呈增大趋势,因N的2p轨道有3个电子,为半充满结构,相对稳定,则第一电离能的大小顺序为 N﹥O﹥C;
(3)SO3分子中S原子孤电子对数为![]() =0,价层电子对数为3+0=3,分子为平面正三角形,分子中正负电荷重心重合,属于非极性分子,NO2-离子中N原子价层电子对数为2+
=0,价层电子对数为3+0=3,分子为平面正三角形,分子中正负电荷重心重合,属于非极性分子,NO2-离子中N原子价层电子对数为2+![]() =3,VSEPR模型为平面三角形;
=3,VSEPR模型为平面三角形;
(4)氧原子半径小于硫原子,氧元素非金属性更强,故氢化物稳定性H2O>H2S;
(5)H、C、O可形成分子式为H2CO的有机物HCHO,HCHO分子内(H2C=O)碳原子形成3个σ键和一个π键,无孤对电子,分子中价层电子对个数=3+0=3,杂化方式为sp2杂化,;1mol该分子中含有π键的数目是1mol;
(6)通常情况下,Co2+的溶液很稳定,它与NH3形成的配位数为6的配离子却不稳定,在空气中易被氧化为[Co(NH3)6]3+,该反应的离子方程式是:4[Co(NH3)6]2++O2+2H2O═4[Co(NH3)6]3++4OH-。

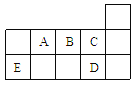
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:

(1)写出元素k的基态原子的电子排布式________________________________,其原子核外有________个未成对电子。
(2)单质c在空气中充分燃烧的产物的分子构型为________ ,中心原子的杂化方式为_______,该分子含有________(填“极性键”或“非极性键”),该分子是________分子(填“极性”或“非极性”)。
(3)上述元素的最高价氧化物的水化物中,酸性最强的是___________________,碱性最的___________________(填化学式)。(每空1分)
(4)d的气态氢化物与d的最高价氧化物的水化物反应的离子方程式是:___________________________________________________________________________________________________________________________________。
(5)o、p两元素的部分电离能数据列于下表:比较两元素的I2、I3可知,气态o2+再失去一个电子比气p2+再失去一个电子困难。对此,你的解是__________________________________________________________________________。
元素 | o | P | |
电离能/kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |

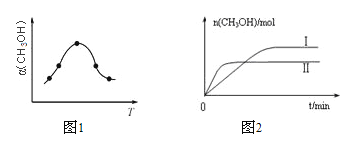
(6)短周期某主族元素的电离能情况如上图所示,则元素是上述周期表的__________元素(填元素符号)。