题目内容
【题目】下列有机物中不含有官能团是( )
A. 烷烃B. 二烯烃C. 苯酚D. 氯代烃
【答案】A
【解析】
A.烷烃中不含有官能团,故A选;
B.二烯烃的官能团为碳碳双键,故B不选;
C.苯酚的官能团为(酚)羟基,故C不选;
D.氯代烃的官能团为氯原子,故D不选。
故选A。

【题目】一氧化碳是一种用途相当广泛的化工基础原料。
⑴. 利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。
Ni(s)+4CO(g)![]() Ni(CO)4(g) 该反应的ΔH_______0(选填“>”或“=”或“<”)。
Ni(CO)4(g) 该反应的ΔH_______0(选填“>”或“=”或“<”)。
⑵. 在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
C(s)+O2(g)=CO2(g);ΔH1=-393.5 kJ·mol-1
CO2(g)+C(s)=2CO(g);ΔH2=+172.5 kJ·mol-1
S(s)+O2(g)=SO2(g);ΔH3=-296.0 kJ·mol-1
则2CO(g)+SO2(g)=S(s)+2CO2(g) ΔH4=________。
⑶. 工业上一般采用CO与H2反应合成可再生能源甲醇,反应如下:
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应达到平衡后,测
得c(CO)=0.2mol·L-1,则CO的转化率为___________。
合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,通过反应进行甲醇合成,T1℃下此反应的平衡常数为160。此温度下,在密闭容器中加入一定量CO和H2,反应到某时刻测得各组分的浓度如下:
物质 | H2 | CO | CH3OH |
浓度/(mol·L-1) | 0.2 | 0.1 | 0.4 |
比较此时正、逆反应速率的大小:v正_______v逆 (填“>”、“<”或“=”);若其他条件不变,在T2℃反应10min后达到平衡,c(H2)=0.4 mol·L-1,则该时间内反应速率:
v(CH3OH) =__________;
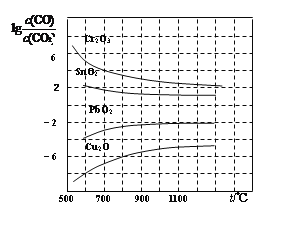
(4)金属氧化物被一氧化碳还原生成金属单质和二氧化碳。下图是四种金属氧化物被一氧化碳还原时lg[c(CO)/c(CO2)]与温度(t)的关系曲线图。800℃时,其中最易被还原的金属氧化物是____(填化学式),该反应的平衡常数数值(K)等于____________。
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:
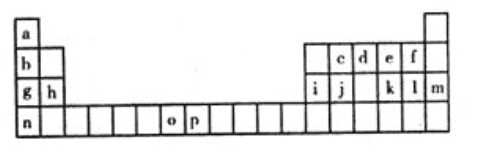
(1)写出元素k的基态原子的电子排布式________________________________,其原子核外有________个未成对电子。
(2)单质c在空气中充分燃烧的产物的分子构型为________ ,中心原子的杂化方式为_______,该分子含有________(填“极性键”或“非极性键”),该分子是________分子(填“极性”或“非极性”)。
(3)上述元素的最高价氧化物的水化物中,酸性最强的是___________________,碱性最的___________________(填化学式)。(每空1分)
(4)d的气态氢化物与d的最高价氧化物的水化物反应的离子方程式是:___________________________________________________________________________________________________________________________________。
(5)o、p两元素的部分电离能数据列于下表:比较两元素的I2、I3可知,气态o2+再失去一个电子比气p2+再失去一个电子困难。对此,你的解是__________________________________________________________________________。
元素 | o | P | |
电离能/kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
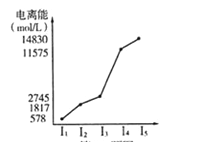
(6)短周期某主族元素的电离能情况如上图所示,则元素是上述周期表的__________元素(填元素符号)。