题目内容
18.某同学从资料上查到以下反应
A、B为中学常见单质,AO2、BO2是能使澄清石灰水变浑浊的气体. 回答下列问题:
(1)元素A、B可形成化合物AB2,则A元素的原子结构示意图为
 ,AB2中的化学键是共价键
,AB2中的化学键是共价键(2)若反应中A和B的质量比为3:4,则n(KClO3):n(AO2)=1:1
(3)已知:
A(s)+O2(g)═AO2(g)△H=-393.5kJ/mol
B(s)+O2(g)═BO2(g)△H=-296.8kJ/mol
A(s)+2B(s)═AB2(l)△H=+89.7kJ/mol
写出AB2(l)在O2中完全燃烧的热化学方程式为AB2(l)+3O2(g)=2BO2(g)+AO2(g)△H=-1076.8kJ/mol.
分析 (1)A、B为中学化学常见单质,AO2、BO2是能使澄清石灰水变浑浊的气体,即为CO2和SO2,即A和B为C和S,而元素A、B可形成化合物AB2,则可以推断A为C,B为S,即BO2为SO2,AO2为CO2,据此分析.
(2)根据守恒配平化学方程式计算二者的物质的量之比即可;
(3)根据热化学方程式的书写方法以及盖斯定律来计算回答.
解答 解:(1)A、B为中学化学常见单质,AO2、BO2是能使澄清石灰水变浑浊的气体,即为CO2和SO2,即A和B为C和S,而元素A、B可形成化合物AB2,则可以推断A为C,B为S,A的原子结构示意图为 ;形成化合物AB2为CS2,二形成于非金属元素之间的键绝大多数为共价键,故CS2中的键为共价键,
;形成化合物AB2为CS2,二形成于非金属元素之间的键绝大多数为共价键,故CS2中的键为共价键,
故答案为: ;共价键;
;共价键;
(2)若反应中A为C和B为S的质量比为3:4,物质的量之比=$\frac{3}{12}$:$\frac{4}{32}$=2:1;
依据原子守恒配平化学方程式得到;2KClO3+2C+S═2KCl+2CO2+SO2,
得到n(KClO3):n(CO2)=1:1,
故答案为:1:1;
(3)已知:a、S(s)+O2(g)═SO2(g),△H=-393.5kJ•mol-1
b、S(s)+O2(g)═SO2(g),△H=-296.8kJ•mol-1
c、C(s)+2S(s)═CS2(l),△H=+89.7kJ•mol-1
二硫化碳燃烧的反应CS2(l)+3O2(g)═2SO2(g)+CO2(g),△H=a+2b-c,
所以△H=(-393.5kJ•mol-1)+2(-296.8kJ•mol-1)-89.7kJ•mol-1=-1076.8kJ•mol-1,
故答案为:CS2(l)+3O2(g)═2SO2(g)+CO2(g),△H=-1076.8kJ•mol-1.
点评 本题考查物质的推导和盖斯定律的应用,解答该题的关键是推导出A和B的物质种类,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 用铜作电极电解Na2SO4溶液:Cu+2H+$\frac{\underline{\;通电\;}}{\;}$Cu2++H2↑ | |
| B. | NH4Al(SO4)2溶液与过量稀氨水反应:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| C. | 用稀硝酸清洗试管内壁的银镜:Ag+2H++NO3-=Ag++NO2↑+H2O | |
| D. | 过量氯气通入碘化亚铁溶液中:2Cl2+2Fe3++2I=4Cl-+2Fe3++I2 |
| A. | 将pH均为a的氢氧化钠溶液和氨水分别加水稀释100倍,pH变为b和c,则a、b、c的大小关系是:a>c>b | |
| B. | 常温下,浓度均为0.1mol/L ①醋酸、②盐酸、③醋酸钠溶液,水的电离程度由大到小的顺序为:③>①>② | |
| C. | 物质的浓度相同的:①氯化铵溶液、②硫酸铵溶液、③碳酸氢铵溶液,pH由大到小的顺序为:③>①>② | |
| D. | 常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为酸性 |
| A. | 相同温度下两种溶液的pH:Na2CO3>NaHCO3 | |
| B. | 若分别升高温度,两种溶液的pH均减小 | |
| C. | 若分别加入少量NaOH,两溶液中c(CO32-)均增大 | |
| D. | 两溶液中的离子浓度均存在关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
| A. | 二氧化硅不与任何酸反应,可用石英制造耐酸容器 | |
| B. | 二氧化氯具有还原性,可用于自来水的杀菌消毒 | |
| C. | 常温下浓硫酸使铝钝化,可在常温下用铝制贮罐贮运浓硫酸 | |
| D. | 二氧化氮溶于水时只生成唯一产物硝酸,工业上利用这一原理生产硝酸 |
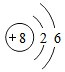 .
.