题目内容
【题目】某课外小组分别用如图所示装置对原电池和电解原理进行实验探究。请回答:
I.用如图所示装置进行第一组实验。
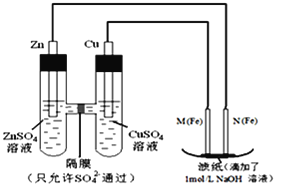
(1)N极发生反应的电极反应式为_________.
(2)实验过程中,SO42-______(填“从左向右”、“从右向左”或“不”)移动;
II.用如图所示装置进行第二组实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。
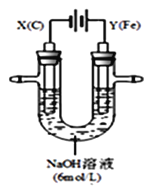
(3)电解过程中,X极区溶液的pH______(填“增大”、“减小”或“不变”)
(4)电解过程中,Y极发生的电极反应为_____________和4OH-- 4e-= 2H2O + O2↑
(5)若在X极收集到672mL气体,在Y极收集到168mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少______g
(6)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4+3Zn═Fe2O3+ZnO+2K2ZnO2 该电池正极发生的反应的电极反应式为__________
【答案】2H++ 2e-= H2↑(或2H2O + 2e-= H2↑+ 2OH-) 从右向左 增大 Fe-6e-+8OH-═FeO42-+4H2O 0.28 2FeO42- + 6e- + 5H2O = Fe2O3 + 10OH-
【解析】
I.(1)N电极连接原电池负极,所以是电解池阴极,阴极上氢离子得电子发生还原反应;
(2)原电池放电时,阴离子向负极移动;
Ⅱ.(3)该电解池中,阳极材料是活泼金属,则电解池工作时,阳极上铁失电子发生氧化反应,同时氢氧根离子失电子生成氧气,阴极上氢离子得电子发生还原反应,氢离子放电生成氢气,则阴极附近氢氧根离子浓度大于氢离子溶液,溶液呈碱性,pH增大;
(4)阳极上铁失电子发生氧化反应;
(5)根据阴阳极上转移电子数相等计算铁反应的质量;
(6)正极发生还原反应,根据元素的化合价降低写出电极反应。
I..(1)N电极连接原电池负极,所以是电解池阴极,阴极上氢离子得电子发生还原反应,电极反应式为:2H++2e-═H2↑(或2H2O+2e-═H2↑+2OH-);
(2)原电池放电时,阴离子向负极移动,所以硫酸根从右向左移动;
(3)电解过程中,阴极上氢离子放电生成氢气,则阴极附近氢氧根离子浓度大于氢离子溶液,溶液呈碱性,溶液的pH增大;
(4)铁是活泼金属,电解池工作时,阳极上铁失电子发生氧化反应,氢氧根离子失电子发生氧化反应,所以发生的电极反应式为:Fe-6e-+8OH-═FeO42-+4H2O和4OH--4e-═2H2O+O2↑;
(5)X电极上析出的是氢气,Y电极上析出的是氧气,且Y电极失电子进入溶液,设铁质量减少为xg,根据转移电子数相等得:生成氢气得到电子的物质的量等于生成氧气时转移电子的物质的量与铁失去电子的物质的量之和,![]() ×2=
×2=![]() ×4+
×4+![]() ×6,解得:x=0.28;
×6,解得:x=0.28;
(6)正极上高铁酸根离子化合价降低,得电子发生还原反应,反应方程式为2FeO42-+6e-+5H2O═Fe2O3+10OH-。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】磁性材料产业是21世纪各国竞相发展的高科技支柱产业之一,磁性材料广泛用于电子信息、军事技术等领域。碳酸锰主要用于制备软磁铁氧体,工业上用氯化铵焙烧锰矿粉制备高纯度碳酸锰的工艺流程如下:
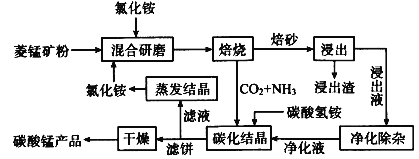
已知:①锰矿粉的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②相关金属Mn+离子c(Mn+)=0.1molL -1形成M(OH)n沉淀的pH范围如下:
金属离子 | Fe3+ | Al3+ | Fe2+ | Mg2+ | Ca2+ | Mn2+ |
开始沉淀的pH | 1.5 | 3.8 | 6.3 | 9.6 | 10.6 | 8.8 |
沉淀完全的pH | 2.8 | 5.2 | 8.3 | 11.6 | 12.6 | 10.8 |
回答下列问题:
(1)“焙烧”时发生的主要反应的化学方程式为___。
(2)浸出液“净化除杂”过程如下:①加入MnO2将Fe2+氧化为Fe3+;②__将Al3+、Fe3+变为沉淀除去;③加入NH4F将__离子沉淀除去。写出反应①的离子方程式为___;
(3)碳化结晶时,反应的离子方程式为___。
(4)碳化结晶过程中不能用碳酸铵溶液代替碳酸氢铵溶液可能的原因是__。流程中能循环利用的物质除了氯化铵之外还有__。
(5)测定碳酸锰产品的纯度。
称取0.5000g碳酸锰产品于锥形瓶中,加25.00mL磷酸,加热,碳酸锰全部转化为[Mn(PO4)2]3-,冷却至室温。加水稀释至100mL,滴加2~3滴指示剂,然后用浓度为0.2000mol·L-1的硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定(反应为:[Mn(PO4)2]3- +Fe2+=Mn2+ +Fe3++2PO43-)。重复操作3次,记录数据如下表:
滴定次数 | 0.2000mol·L-1的硫酸亚铁铵标准溶液读数(mL) | |
滴定前 | 滴定后 | |
1 | 0.10 | 20.20 |
2 | 1.32 | 21.32 |
3 | 1.05 | 20.95 |
则产品的纯度=__,若滴定终点时发现滴定管尖嘴处产生了气泡,则测得的碳酸锰粗产品的纯度__(填“偏高”“偏低”或“无影响”)。