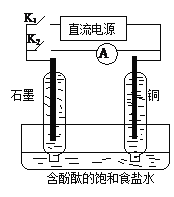
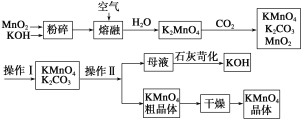
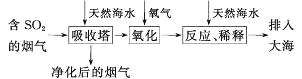
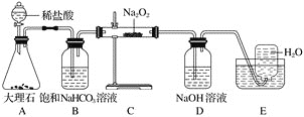
题目内容
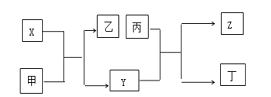
【题目】由短周期主族元素X、Y、Z组成的单质(化学式也分别为X、Y、Z),X为金属,其核外电子数为Y原子序数的2倍,Y的最低负化合价与Z的最高正化合价的数值相等,甲、乙、丙、丁四种均为氧化物,甲和丁为无色的气体,固体甲可用于人工降雨,乙和丙熔点均很高,且它们在一定条件下能发生如下反应,下列说法中正确的是( )
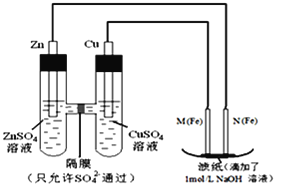
A.X为第三周期II族元素,Y和Z位于同一主族
B.甲、乙、丙均能与水发生化合反应
C.工业上常用电解乙制备X
D.X可用于制焰火烟花,Z可用作太阳能电池的材料
【答案】D
【解析】
甲为氧化物,且为无色的气体,固体甲可用于人工降雨,甲为CO2;X为金属,根据框图,X能够与二氧化碳反应,X为Mg;X的核外电子数为Y原子序数的2倍,Y为C,乙为MgO;Y的最低负化合价与Z的最高正化合价的数值相等,则Z为Si,甲、乙、丙、丁四种均为氧化物,甲和丁为无色的气体,乙和丙熔点均很高,则丙为SiO2,丁为CO,据此分析解答。
由上述分析可知,X为Mg,Y为C,Z为Si,甲为CO2,乙为MgO,丙为SiO2,丁为CO。
A.X为Mg,位于第三周期IIA族,Y、Z均位于ⅣA族,故A错误;
B.乙、丙均不能与水反应,而甲与水发生化合反应生成碳酸,故B错误;
C.MgO的熔点高,应电解熔融氯化镁冶炼Mg,故C错误;
D.Mg燃烧发生耀眼的白光,Si为半导体材料,则X可用于制焰火烟花,Z可用作太阳能电池的材料,故D正确;
故选D。

【题目】铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为 Cu2S,含少量 Fe2O3、SiO2 等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:

已知:
①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |
② Ksp[Fe(OH)3]=4.0×10-38
(1)加快“浸取”速率,除适当增加硫酸浓度外,还可采取的措施有__________(任写一种)。
(2)滤渣I中的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S的化学方程式:______________。
(3)常温下“除铁”时加入的试剂A可用CuO等,调节pH调的范围为_________,若加 A 后溶液的 pH调为4.0,则溶液中 Fe3+的浓度为_________mol/L。
(4)写出“沉锰”(除 Mn2+)过程中反应的离子方程式:_________________________。
(5)“赶氨”时,最适宜的操作方法是________________。
(6)过滤Ⅱ得到的沉淀经过洗涤、干燥可以得到碱式碳酸铜,判断沉淀是否洗净的操作是________________。