题目内容
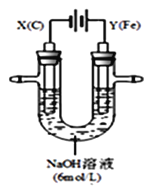
【题目】某化学兴趣小组欲利用MnO2和浓盐酸及如图所示装置制备Cl2。下列分析中不正确的是
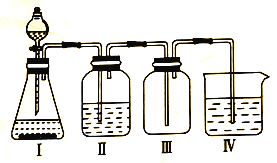
A.I中缺少加热装置
B.Ⅱ为净化Cl2的装置,其盛放的是NaOH溶液
C.Ⅲ为收集Cl2的装置
D.Ⅳ中处理多余的Cl2时,Cl2既作氧化剂,又作还原剂
【答案】B
【解析】
A. 二氧化锰和浓盐酸需要加热才能反应生成氯气,需要添加加热装置,所以A选项是正确的;
B. Ⅱ中盛放的NaOH溶液吸收氯气,不能净化Cl2,可以用饱和食盐水除去氯气中的氯化氢,故B错误;
C. 氯气的密度比空气大,用向上排空气法收集,导管长进短出,所以C选项是正确的;
D.氢氧化钠溶液与氯气反应,生成氯化钠、次氯酸钠和水,Cl2既作氧化剂,又作还原剂,所以D选项是正确的。
答案选B。

练习册系列答案
相关题目
【题目】已知反应X(g)+Y(g)![]() R(g)+Q(g)的平衡常数与温度的关系如表所示。830 ℃时,向一个2 L的密闭容器中充入0.2 mol X和0.8 mol Y,反应初始4 s内v(X)=0.005 mol/(L·s)。下列说法正确的是
R(g)+Q(g)的平衡常数与温度的关系如表所示。830 ℃时,向一个2 L的密闭容器中充入0.2 mol X和0.8 mol Y,反应初始4 s内v(X)=0.005 mol/(L·s)。下列说法正确的是
温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
A. 4 s时容器内c(Y)=0.76 mol/L
B. 830 ℃达平衡时,X的转化率为80%
C. 反应达平衡后,升高温度,平衡正向移动
D. 1 200 ℃时反应R(g)+Q(g) ![]() X(g)+Y(g)的平衡常数K=0.4
X(g)+Y(g)的平衡常数K=0.4