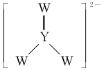
题目内容
【题目】把2.3 g钠投入足量水中,充分反应后所得溶液用水稀释至100 mL。求:
(1)生成标准状况下的氢气多少升_______;
(2)所得的溶液物质的量浓度_______?
【答案】1.12 1 mol/L
【解析】
(1)先根据n=![]() 由Na的质量计算其物质的量,再利用Na与水反应的方程式中Na与H2的物质的量关系,计算H2的物质的量,结合V=n·Vm计算H2在标准状况下的体积;
由Na的质量计算其物质的量,再利用Na与水反应的方程式中Na与H2的物质的量关系,计算H2的物质的量,结合V=n·Vm计算H2在标准状况下的体积;
(2)根据方程式可知Na与H2O反应产生的NaOH的物质的量,利用c=![]() 计算其物质的量浓度。
计算其物质的量浓度。
Na与H2O反应方程式为:2Na+2H2O=2NaOH+H2↑。
(1)2.3 gNa的物质的量n(Na)= ![]() =0.1 mol,根据方程式可知Na与反应产生的H2的物质的量关系n(H2)=
=0.1 mol,根据方程式可知Na与反应产生的H2的物质的量关系n(H2)=![]() n(Na)=
n(Na)=![]() ×0.1 mol=0.05 mol,则生成的H2在标准状况下的体积V(H2)= n·Vm=0.05 mol×22.4 L/mol=1.12 L;
×0.1 mol=0.05 mol,则生成的H2在标准状况下的体积V(H2)= n·Vm=0.05 mol×22.4 L/mol=1.12 L;
(2)根据方程式可知n(NaOH)=n(Na)=0.1 mol,由于反应后溶液体积是100 mL=0.1 L,所以反应产生的NaOH的物质的量浓度c(NaOH)=![]() =1 mol/L。
=1 mol/L。

【题目】铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为 Cu2S,含少量 Fe2O3、SiO2 等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:

已知:
①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |
② Ksp[Fe(OH)3]=4.0×10-38
(1)加快“浸取”速率,除适当增加硫酸浓度外,还可采取的措施有__________(任写一种)。
(2)滤渣I中的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S的化学方程式:______________。
(3)常温下“除铁”时加入的试剂A可用CuO等,调节pH调的范围为_________,若加 A 后溶液的 pH调为4.0,则溶液中 Fe3+的浓度为_________mol/L。
(4)写出“沉锰”(除 Mn2+)过程中反应的离子方程式:_________________________。
(5)“赶氨”时,最适宜的操作方法是________________。
(6)过滤Ⅱ得到的沉淀经过洗涤、干燥可以得到碱式碳酸铜,判断沉淀是否洗净的操作是________________。