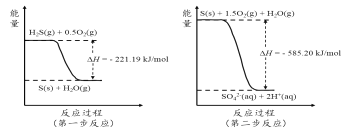
题目内容
【题目】为了探究Cl2、SO2同时通入H2O中发生的反应,某化学兴趣小组同学设计了图1所示的实验装置。
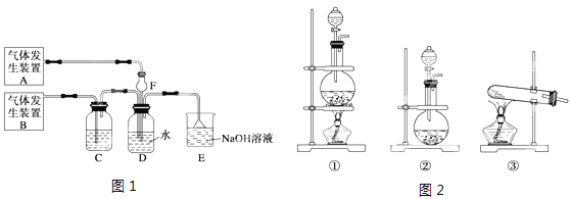
(1)该化学兴趣小组同学为制取Cl2和SO2气体,现采用Na2SO3与70%的浓硫酸为原料制取SO2,采用MnO2和浓盐酸(12mol/L)为原料制取Cl2。请写出制取Cl2的离子方程式:
(2)在此实验中,F仪器的作用是:______________;发生装置B应选择图2三种装置中的___________(填序号)。
(3)D装置中主要反应的离子方程式为 。
(4)为验证通入D装置中过量的气体是Cl2还是SO2气体,兴趣小组的同学准备了以下试剂:
①氯化铁溶液 ②氯化亚铁溶液 ③硫氰酸钾溶液
④品红溶液 ⑤溴水 ⑥稀硝酸
A.若Cl2过量:取适量D中溶液滴加至盛有 试剂的试管内,发生的现象是: ;(试剂可以多选,请填试剂的序号,下同)。
B.若SO2过量:取适量D中溶液滴加至盛有 试剂的试管内,发生的现象是: 。
【答案】(1)MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)防止倒吸;①;
(3)Cl2+SO2+2H2O=4H++2Cl-+ SO42-;
(4)A.② ③;溶液变为红色;
B.答案一:④;品红溶液褪色,加热后溶液颜色恢复;(不强调加热溶液颜色恢复不给分);
答案二:⑤;溶液橙黄色褪去。
答案三:①;溶液黄色褪去。
答案四:①③;溶液不显红色。(所选试剂与现象一致才给分)。
【解析】
试题分析:(1)MnO2和浓盐酸反应制取Cl2,反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)SO2易与水反应,且溶解度较大会发生倒吸,则F可以防倒吸,装置B为制取氯气的装置,由固液反应且加热的原理可知应选择①,故答案为:防止倒吸;①;
(3)D中是二氧化硫和氯气发生的氧化还原反应生成硫酸和盐酸,反应的离子方程式为:Cl2+SO2+2H2O═4H++2Cl-+SO42-,故答案为:Cl2+SO2+2H2O═4H++2Cl-+SO42-;
(4)A.为验证通入D装置中的气体是Cl2还是SO2过量,若Cl2过量,取适量D中溶液滴加至盛有氯化亚铁溶液,试剂的试管内,再加入硫氰化钾溶液会变血红色,证明氯气氧氧化亚铁离子;故答案为:②;③;溶液呈血红色;
B.若SO2过量,取适量D中溶液滴加至盛有品红溶液的试管中,红色褪去,加热又恢复红色,证明含有二氧化硫,故答案为:④;红色褪去为无色,加热后又变为红色。

【题目】 I.在实验室利用下列装置,可制备某些气体并验证其化学性质。
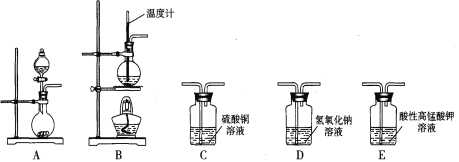
完成下列表格:
序号 | 气体 | 装置连接顺序(填字母) | 制备反应的化学方程式 |
(1) | 乙烯 | __________________ | _________________________ |
(2) | 乙炔 | A→C→E | _________________________ |
II.工业上用乙烯、氯化氢和氯气为原料,经下列各步合成聚氯乙烯(PVC):

A的结构简式是__________________________________________________;
反应④的化学方程式是_________________________________________。
【题目】A、B、C为短周期元素,在周期表中所处的位置如图所示。
A | C | |
B |
A、C两元素的原子核外电子数之和等于B原子的质子数。
(1)写出A、B元素的名称 、 。
(2)B位于元素周期表中第 周期第 族。
(3)C的原子结构示意图为 。
(4)写出A的气态氢化物与其最高价氧化物对应的水化物反应的化学方程式 。