题目内容
(10分)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+ 2H2(g) CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
(1)下列措施中有利于增大该反应的反应速率的是_____________。
(2)乙醇燃料电池具有很高的实用价值。下图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。则该电池的负极反应式为 。

(3)已知:CO(g)+1/2 O2(g)=CO2(g);△H2=-283 kJ·mol-1
H2(g)+1/2 O2(g)=H2O(g) △H3=-242 kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO 2和水蒸气时的热化学方程式为
(4)在容积为2L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。下图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为2mol)与CO平衡转化率的关系。请回答:

①在上述三种温度中,曲线Z对应是 。
②利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+ 2H2(g) CH3OH(g) 的平衡常数K = 。
CH3OH(g) 的平衡常数K = 。
CO(g)+ 2H2(g)
 CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1(1)下列措施中有利于增大该反应的反应速率的是_____________。
| A.随时将CH3OH与反应混合物分离 |
| B.降低反应温度 |
| C.增大体系压强 |
| D.使用高效催化剂 |

(3)已知:CO(g)+1/2 O2(g)=CO2(g);△H2=-283 kJ·mol-1
H2(g)+1/2 O2(g)=H2O(g) △H3=-242 kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO 2和水蒸气时的热化学方程式为
(4)在容积为2L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。下图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为2mol)与CO平衡转化率的关系。请回答:

①在上述三种温度中,曲线Z对应是 。
②利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+ 2H2(g)
 CH3OH(g) 的平衡常数K = 。
CH3OH(g) 的平衡常数K = 。(1)CD (2)CH3CH2OH+H2O-4e-=CH3COOH+4H+
(3)CH3OH(g)+3/2O2(g) =CO2(g)+ 2H2O(g) △H=-651kJ·mol-1
(4)①270℃ ②4
(3)CH3OH(g)+3/2O2(g) =CO2(g)+ 2H2O(g) △H=-651kJ·mol-1
(4)①270℃ ②4
试题分析:(1)增大浓度、升高温度、增大压强和使用催化剂都能加快化学反应速率,否则,化学反应速率会降低,故选CD。(2)原电池中的负极失去电子,又因是酸性的燃料电池,所以负极反应式为:CH3CH2OH+H2O-4e-=CH3COOH+4H+。(3)将(3)中第2个热化学方程式*2在和(3)中的第一个热化学方程式叠加再减去题中的热化学方程式即可得解为:CH3OH(g)+3/2O2(g) =CO2(g)+ 2H2O(g) △H=-651kJ·mol-1。
点评:本题考查学生有关化学平衡以及热化学知识,学生可以根据所学知识来回答,难度较大。

练习册系列答案
相关题目
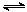 2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大
2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大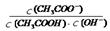 的值不变
的值不变 CO(g)+H2(g),则可用来判断该反应达到平衡状态的标志有 。(填字母)
CO(g)+H2(g),则可用来判断该反应达到平衡状态的标志有 。(填字母) HCOOCH3(g) △H=-29.1 kJ·mol-1
HCOOCH3(g) △H=-29.1 kJ·mol-1
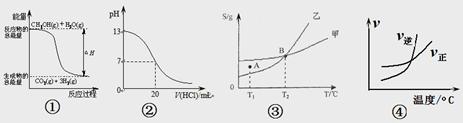
 2AB3(g)”的ΔH>0
2AB3(g)”的ΔH>0
 CO2(g) + H2(g)△H1=" +" 41.2kJ/mol
CO2(g) + H2(g)△H1=" +" 41.2kJ/mol CO2(g) + H2(g)△H1=" +" 41.2kJ/mol
CO2(g) + H2(g)△H1=" +" 41.2kJ/mol