题目内容
下列有关说法正确的是
A.对于反应2SO2(g)+O2(g)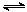 2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大 2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大 |
| B.电解法精炼铜时,精铜作阳极,粗铜作阴极 |
| C.在硫酸钡悬浊液中加入足量饱和Na2CO3溶液处理,向所得沉淀中加入盐酸有气体产生,说明Ksp(BaSO4)>Ksp(BaCO3) |
D.CH3COOH溶液加水稀释后,电离程度增大,溶液中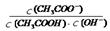 的值不变 的值不变 |
D
试题分析:A、压缩气体体积使压强增大,平衡向气体系数减小的方向移动,即向正反应方向移动,SO2的转化率增大,但平衡常数不变,错误;B、电解法精炼铜时,粗铜作阳极,精铜作阴极,错误;C、在硫酸钡悬浊液中加入足量饱和Na2CO3溶液,向所得沉淀中加入盐酸有气体产生,BaSO4沉淀转化为BaCO3沉淀,因为饱和Na2CO3溶液中CO32?浓度大,硫酸钡悬浊液中SO42?浓度很小,所以无法判断Ksp(BaSO4)与Ksp(BaCO3)的大小,错误;D、CH3COOH溶液加水稀释后,电离程度增大,
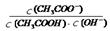 等于Ka/Kw,值不变,正确。
等于Ka/Kw,值不变,正确。
练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目

 2NH3(g),当其他条件不变时,压缩气体体积使压强增大,正反应和逆反应速率以及H2的平衡转化率均增大
2NH3(g),当其他条件不变时,压缩气体体积使压强增大,正反应和逆反应速率以及H2的平衡转化率均增大
 H3O++S2-
H3O++S2- 2NH3(g) △H<0,其他条件不变时升高温度,反应速率V(H2)增大,氢气的平衡转化率变小
2NH3(g) △H<0,其他条件不变时升高温度,反应速率V(H2)增大,氢气的平衡转化率变小 O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1



 ,其它条件不变时加入催化剂,反应速率v(SO2)和SO2转化率均增大
,其它条件不变时加入催化剂,反应速率v(SO2)和SO2转化率均增大 CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
