题目内容
【题目】元素周期表是学习物质结构和性质的重要工具,下面是元素周期表的一部分,表中所列字母A、D、E、G、Q、M、R分别代表某一化学元素。请用所给元素回答下列问题。
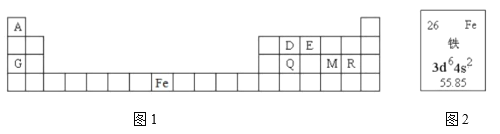
(1)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为_____________。R原子的最外层电子排布式____________________________;原子核外有________种能量不同的电子。R原子最外层有________种运动状态不同的电子。
(2)元素Fe在元素周期表中的位置是__________________________________________。图2中,55.85表示__________________________________________________________。
(3)表中某些元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是____________________(填离子符号)。
(4)M、D两种元素形成的化合物含有的化学键类型是____________________(填“极性键”或“非极性键”),其分子是____________________(填“极性分子”或“非极性分子”)。D、Q的最高价氧化物形成的晶体相比,熔点较高的是____________________(用化学式表示)。
(5)表中金属性最强的元素与铝元素相比较,可作为判断金属性强弱依据的是________(选填编号)。
a.能否置换出铝盐溶液中铝
b.![]() 能否溶解在该元素最高价氧化物对应水化物中
能否溶解在该元素最高价氧化物对应水化物中
c.单质与氢气化合的难易程度
d.单质与同浓度的稀盐酸发生反应的剧烈程度
(6)在![]() 溶液中逐滴加入G的最高价氧化物的水化物,现象是先产生白色沉淀,然后白色沉淀逐渐消失。请用以上某化学方程式证明Al与G金属性的强弱。______________________。O的非金属性比N强,请用元素周期律的知识分析原因。___________________。
溶液中逐滴加入G的最高价氧化物的水化物,现象是先产生白色沉淀,然后白色沉淀逐渐消失。请用以上某化学方程式证明Al与G金属性的强弱。______________________。O的非金属性比N强,请用元素周期律的知识分析原因。___________________。
【答案】![]()
![]() 5 7 第四周期Ⅷ族 Fe元素的相对原子质量
5 7 第四周期Ⅷ族 Fe元素的相对原子质量 ![]() 极性键 非极性分子
极性键 非极性分子 ![]() bd
bd ![]() ,证明碱性
,证明碱性![]() O与N是同周期元素且O在N的右边,同一周期从左到右,非金属性逐渐增强,所以非金属性O大于N
O与N是同周期元素且O在N的右边,同一周期从左到右,非金属性逐渐增强,所以非金属性O大于N
【解析】
根据元素在周期表中的位置分析可知,A为H元素,D为C元素,E为O元素,G为Na元素,Q为Si元素,M为S元素,R为Cl元素,结合元素周期律与物质的结构与性质的关系分析作答。
(1)根据可知,某元素原子的核外电子层数是最外层电子数的3倍,则该元素为Na,其原子结构示意图为![]() ;R为Cl元素,原子序数为17,其最外层电子排布式为:
;R为Cl元素,原子序数为17,其最外层电子排布式为:![]() ;电子排布式为:1s22s22p63s23p5,不同的能级所具有的能量不同,故原子核外有5种能量不同的电子;每个电子的运动状态均不相同,因此Cl原子最外层有7种不同运动状态的电子;
;电子排布式为:1s22s22p63s23p5,不同的能级所具有的能量不同,故原子核外有5种能量不同的电子;每个电子的运动状态均不相同,因此Cl原子最外层有7种不同运动状态的电子;
(2)元素Fe的原子序数为26,在元素周期表中的位置为第四周期Ⅷ族,55.85表示Fe元素的相对原子质量;
(3)Ar的原子结构示意图为:![]() ,则上述元素中,与Ar具有相同电子层结构的微粒为S2-和Cl-,因同周期中,具有相同电子层结构的简单粒子核电荷数越小,其半径越大,故两者的大小顺序为:
,则上述元素中,与Ar具有相同电子层结构的微粒为S2-和Cl-,因同周期中,具有相同电子层结构的简单粒子核电荷数越小,其半径越大,故两者的大小顺序为:![]() ;
;
(4)M、D分别是S和C,两者形成的化合物为CS2,由2对碳硫双键形成的直线型结构,是由极性键组成的非极性分子;D、Q的最高价氧化物形成的晶体分别是CO2和SiO2,因CO2分子晶体,而SiO2为原子晶体,则熔点较高的是SiO2;
(5)表中金属性最强的元素为Na,与Al相比:
a. Na在盐溶液中首先与水反应,不会置换出铝,不能作为判断依据,a项错误;
b. ![]() 能否溶解在NaOH中,说明NaOH为强碱,可作为判断依据,b项正确;
能否溶解在NaOH中,说明NaOH为强碱,可作为判断依据,b项正确;
c. 单质与氢气化合的难易程度,是判断非金属性强弱的依据,c项错误;
d. 单质与同浓度的稀盐酸发生反应的剧烈程度,体现了金属的活动性强弱,即金属性强弱,d项正确;
故答案为:bd;
(6)先产生白色沉淀,然后白色沉淀逐渐消失,说明NaOH溶解了![]() ,其化学方程式为:
,其化学方程式为:![]() ,故碱性比较:NaOH>
,故碱性比较:NaOH>![]() ,即金属性:Na>Al;O与N是同周期元素且O在N的右边,同一周期从左到右,非金属性逐渐增强,所以非金属性O大于N,故答案为:
,即金属性:Na>Al;O与N是同周期元素且O在N的右边,同一周期从左到右,非金属性逐渐增强,所以非金属性O大于N,故答案为:![]() ,证明碱性
,证明碱性![]() ;O与N是同周期元素且O在N的右边,同一周期从左到右,非金属性逐渐增强,所以非金属性O大于N。
;O与N是同周期元素且O在N的右边,同一周期从左到右,非金属性逐渐增强,所以非金属性O大于N。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案【题目】醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1-溴丁烷的反应如下:
NaBr+H2SO4=HBr+NaHSO4①
R—OH+HBr![]() R—Br+H2O②
R—Br+H2O②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。有关数据见下表:
乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
密度/g.cm3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
请回答下列问题:
(1)溴乙烷和1溴丁烷的制备实验中,下列仪器最不可能用到的是________(填字母)。
a.圆底烧瓶 b.量筒 c.锥形瓶 d.布氏漏斗
(2)溴代烃的水溶性________(填“大于”、“等于”或“小于”)相应的醇,其原因是______________________________________________________________。
(3)将1溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在________(填“上层”“下层”或“不分层”)。
(4)制备操作中,加入的浓硫酸必须进行稀释,其目的是________(填字母)。
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(5)欲除去溴乙烷中的少量杂质Br2,下列物质中最适合的是________(填字母)。
a.NaI b.NaOH c.NaHSO3 d.KCl
(6)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于___________________,但在制备1溴丁烷时却不能边反应边蒸出产物,其原因是___________________________。