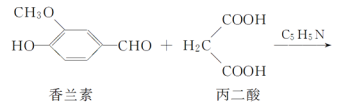题目内容
【题目】已知断裂1 mol共价键所需要吸收的能量分别为H—H:436 kJ,I—I:151 kJ,H—I:299 kJ,下列对H2(g)+I2(g)![]() 2HI(g)的反应类型判断错误的是( )
2HI(g)的反应类型判断错误的是( )
A.放出能量的反应B.吸收能量的反应
C.氧化还原反应D.可逆反应
【答案】B
【解析】
依题意,断裂1 mol H—H键和1 mol I—I键吸收的能量为436 kJ+151 kJ=587 kJ,生成2 mol H—I键放出的能量为299 kJ×2=598 kJ,因为598 kJ>587 kJ,即反应过程中放出的能量大于吸收的能量,所以该反应的正反应是放出能量的反应;根据反应式可知该反应是可逆反应;反应中有元素化合价发生变化,是氧化还原反应,故答案为B。

练习册系列答案
相关题目