题目内容
14.某溶液中加入氯化钡溶液生成白色沉淀,再加入稀硝酸沉淀不溶解也无气体逸出,则这种溶液中( )| A. | 一定含有SO42- | B. | 一定含有Ag+ | ||
| C. | 可能不含CO32- | D. | 可能含有SO42-或Ag+ |
分析 BaCl2溶液中含有钡离子和氯离子,钡离子能形成硫酸钡沉淀,氯离子能形成氯化银沉淀,二者都是不溶于盐酸的白色沉淀,白色沉淀可能为氯化银或硫酸钡,以此解答该题.
解答 解:加入氯化钡溶液,若溶液中含有硫酸根离子,则白色沉淀为硫酸钡,若溶液中含有银离子离子,则白色沉淀为氯化银,则溶液中可能含有SO42-或Ag+;加入稀硝酸没有气体生成,则没有CO32-,
A.溶液中不一定含有SO42-,故A错误;
B.溶液中不一定含有Ag+,故B错误;
C.加入稀硝酸没有气体生成,则没有CO32-,故C错误;
D.依据上述分析可知,溶液中可能含有SO42-或Ag+,故D正确;
故选D.
点评 本题考查了离子性质和离子检验,为高频考点,侧重于学生的分析能力的考查,掌握硫酸根的检验方法以及银离子的检验方法是解题的关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.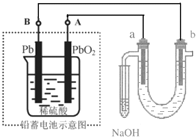 用铅蓄电池(总反应:2PbSO4+2H2O$?_{放电}^{充电}$ Pb+PbO2+4H++2SO42- )电解苦卤水 (含C1-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极).下列说法中正确的是( )
用铅蓄电池(总反应:2PbSO4+2H2O$?_{放电}^{充电}$ Pb+PbO2+4H++2SO42- )电解苦卤水 (含C1-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极).下列说法中正确的是( )
 用铅蓄电池(总反应:2PbSO4+2H2O$?_{放电}^{充电}$ Pb+PbO2+4H++2SO42- )电解苦卤水 (含C1-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极).下列说法中正确的是( )
用铅蓄电池(总反应:2PbSO4+2H2O$?_{放电}^{充电}$ Pb+PbO2+4H++2SO42- )电解苦卤水 (含C1-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极).下列说法中正确的是( )| A. | 铅蓄电池放电时的正极反应是:PbO2+4H++SO42-═PbSO4+2H2O | |
| B. | 电解苦卤水时,a 电极首先放电的是Br-而不是Cl-,说明当其它条件相同时Br-的还原性强于Cl- | |
| C. | 铅蓄电池充电时,A极应与外接电源负极相连 | |
| D. | 忽略能量消耗,当b极产生0.02g气体时,铅蓄电池中消耗0.01 molH2SO4 |
4.要除去混在CO2气体中少量CO,最好的方法是( )
| A. | 点燃 | B. | 通氧气并点燃 | C. | NaOH溶液 | D. | 过灼热的氧化铜 |
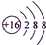 ,A在周期表中的位置为第三周期ⅢA族.
,A在周期表中的位置为第三周期ⅢA族.
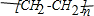 ,反应类型加聚反应;
,反应类型加聚反应;
 .
.