题目内容
5.A、D、B、E为前四周期的元素,且原子序数依次增大.其中A、B、D同周期,A3+比B-少一个电子层;D的一种氧化物是形成酸雨的主要物质;E元素的单质与H2O高温下反应,生成物中有一种具有磁性的黑色晶体X.请回答下列问题:(1)D的离子结构示意图为
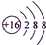 ,A在周期表中的位置为第三周期ⅢA族.
,A在周期表中的位置为第三周期ⅢA族.(2)B、D元素的最高价氧化物对应的水化物的酸性强弱为HClO4>H2SO4(用化学式回答).
(3)将AB3溶于污水有沉淀生成,用化学方程式解释这一现象AlCl3+3H2O?Al(OH)3+3HCl
(4)将m g X溶于足量HI溶液,离子方程式为Fe3O4+8H++2I-═I2+3Fe2++4H2O.向溶液中加入5mLCCl4振荡后静置,观察CCl4层紫红色;分液后向水层中加入足量NaOH溶液,过滤、洗涤、在空气中灼烧,可得到红色固体,其质量为$\frac{30m}{29}$g.
分析 A、D、B、E为前四周期的元素,且原子序数依次增大.E元素的单质与H2O高温下反应,生成物中有一种具有磁性的黑色晶体X,则E为Fe,X为Fe3O4,而A、B、D同周期,A3+比B-少一个电子层,D的一种氧化物是形成酸雨的主要物质,应属于第三周期,可推知A为Al、D为S、B为Cl,据此解答.
解答 解:A、D、B、E为前四周期的元素,且原子序数依次增大.E元素的单质与H2O高温下反应,生成物中有一种具有磁性的黑色晶体X,则E为Fe,X为Fe3O4,而A、B、D同周期,A3+比B-少一个电子层,D的一种氧化物是形成酸雨的主要物质,应属于第三周期,可推知A为Al、D为S、B为Cl.
(1)D为S元素,S2-离子结构示意图为 ,A为Al元素,在周期表中的位置为第三周期ⅢA族,
,A为Al元素,在周期表中的位置为第三周期ⅢA族,
故答案为: ;第三周期ⅢA族;
;第三周期ⅢA族;
(2)非金属性Cl>S,故最高价氧化物对应的水化物的酸性强弱为HClO4>H2SO4,
故答案为:HClO4>H2SO4;
(3)将AlCl3溶于污水有沉淀生成,用化学方程式解释原因为:AlCl3+3H2O?Al(OH)3+3HCl,
故答案为:AlCl3+3H2O?Al(OH)3+3HCl;
(4)X为Fe3O4,与HI反应得到铁离子具有强氧化性,可以氧化碘离子为碘单质,反应离子方程式为:Fe3O4+8H++2I-═I2+3Fe2++4H2O,向溶液中加入5mLCCl4振荡后静置,四氯化碳萃取溶液中碘单质,观察CCl4层紫红色;分液后向水层中加入足量NaOH溶液,过滤、洗涤、在空气中灼烧,可得到红色固体为Fe2O3,根据Fe元素守恒可知,其质量为$\frac{mg}{232g/mol}$×3×$\frac{1}{2}$×160g/mol=$\frac{30m}{29}$g,
故答案为:Fe3O4+8H++2I-═I2+3Fe2++4H2O;紫红;$\frac{30m}{29}$.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,(4)中注意利用守恒进行计算,难度中等.

| A. | 对于吸热反应,由于吸收热量后反应体系的温度升高 | |
| B. | 对于吸热反应,生成物的总能量,高于反应物的总能量 | |
| C. | 对于放热反应,放出热量后反应体系的温度降低 | |
| D. | 对于放热反应,生成物的总能量高于反应物的总能量 |
| A. | 原子半径 A>B>C | |
| B. | 阴离子的还原性按A、B、C的顺序由强到弱 | |
| C. | 非金属性 A>B>C | |
| D. | 气态氢化物的稳定性按A、B、C的顺序由弱到强 |
| A. | 加入稀盐酸产生无色气体,原物质一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入稀盐酸后再加入硝酸银,产生白色沉淀,则原溶液一定有Cl- | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,不一定有Ba2+ |
| A. | 0.9375d | B. | 0.9685d | C. | 1.0655d | D. | 0.9135d |
| A. | 一定含有SO42- | B. | 一定含有Ag+ | ||
| C. | 可能不含CO32- | D. | 可能含有SO42-或Ag+ |
| A. | 保持温度不变,再加0.2mol•L-1的HA溶液 | |
| B. | 保持浓度不变,升高温度 | |
| C. | 保持温度不变,加水 | |
| D. | 增大压强 |

 .
.