题目内容
以NA代表阿伏加德罗常数,则关于热化学方程式C2H2(g)+
O2(g)═2CO2(g)+H2O(l)△H=-1300kJ?mol-1的说法中,正确的是( )
| 5 |
| 2 |
| A.10NA个电子转移时,该反应放出1300kJ的能量 |
| B.NA个水分子生成且为液体时,吸收1300kJ的能量 |
| C.有2NA个碳氧共用电子对生成时,放出1300kJ的能量 |
| D.有10NA个碳氧共用电子对生成时,放出1300kJ的能量 |
A.10NA个电子的物质的量为10mol,反应中碳元素的化合价由-1价升高为+4,参加反应的乙炔的物质的量为
=1mol,放出的热量为1300kJ/mol×1mol=1300kJ,故A正确;
B.热化学方程式中△H<0表示放热,C2H2(g)+
O2(g)=2CO2(g)+H2O(l)△H=-1300kJ/mol该反应为放热反应,有NA个水分子生成且为液体时,放出1300kJ的能量,故B错误;
C.1个CO2分子中含有4个共用电子对,有8NA个碳氧共用电子对生成时,说明有2molCO2生成,放出1300KJ的能量,有2NA个碳氧共用电子对生成时,说明有0.5molCO2生成,放出
=325KJ的能量,故C错误;
D.1个CO2分子中含有4个共用电子对,有10NA个碳氧共用电子对生成时,说明有2.5molCO2生成,放出的能量为1300KJ×
=1625KJ,故D错误;
故选A.
| 10mol |
| 2×5 |
B.热化学方程式中△H<0表示放热,C2H2(g)+
| 5 |
| 2 |
C.1个CO2分子中含有4个共用电子对,有8NA个碳氧共用电子对生成时,说明有2molCO2生成,放出1300KJ的能量,有2NA个碳氧共用电子对生成时,说明有0.5molCO2生成,放出
| 1300KJ |
| 4 |
D.1个CO2分子中含有4个共用电子对,有10NA个碳氧共用电子对生成时,说明有2.5molCO2生成,放出的能量为1300KJ×
| 2.5 |
| 2 |
故选A.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
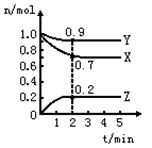
 PCl3(g) +Cl2(g) △H=+Qkj.mol-1维持容器温度不变,测得容器内压强随反应时间的变化如图所示。下列说法正确的是
PCl3(g) +Cl2(g) △H=+Qkj.mol-1维持容器温度不变,测得容器内压强随反应时间的变化如图所示。下列说法正确的是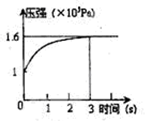
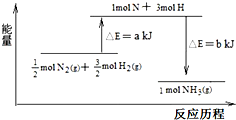
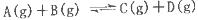 过程中的能量变化如图所示,下列说法错误的是
过程中的能量变化如图所示,下列说法错误的是