题目内容
(8分)某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:

(1)该反应的化学方程式 。
(2)反应开始至2min,以气体Z表示的平均反应速率为 。
(3)若X、Y、Z均为气体,2min后反应达到平衡,反应达平衡时:
①此时体系的压强是开始时的 倍;
②达平衡时,容器内混合气体的平均相对分子质量比起始投料时_______(填“增大”“减小”或“相等”)。

(1)该反应的化学方程式 。
(2)反应开始至2min,以气体Z表示的平均反应速率为 。
(3)若X、Y、Z均为气体,2min后反应达到平衡,反应达平衡时:
①此时体系的压强是开始时的 倍;
②达平衡时,容器内混合气体的平均相对分子质量比起始投料时_______(填“增大”“减小”或“相等”)。
(8分)(1)3X+Y  2Z(3分) (2)0.05mol.(L.min)-1 (2分) (3)0.9 (2分) 增大(1分)
2Z(3分) (2)0.05mol.(L.min)-1 (2分) (3)0.9 (2分) 增大(1分)
 2Z(3分) (2)0.05mol.(L.min)-1 (2分) (3)0.9 (2分) 增大(1分)
2Z(3分) (2)0.05mol.(L.min)-1 (2分) (3)0.9 (2分) 增大(1分)试题分析:(1)X和Y的物质的量减小,故X和Y是反应物,Z是生成物,转化量之比等于系数之比,当2分钟时,X减少了0.1mol,Y减少了0.3mol,Z增加了0.2mol,故系数之比为1:3:2,故方程式为:3X+Y
 2Z;(2)2分钟时,物质的量增加了0.2mol,浓度变化量为0.1mol/L,除以时间2分钟,即得该时间内的平均反应速率;(3)①体积不变的情况下,容器内的压强之比等于气体的物质的量之比,开始时容器内气体的总物质的量为X:1mol、Y:1mol,共2mol,2分钟后:X:0.9mol、Y:0.7mol、Z:0.2mol,共1.8mol,故压强之比是1.8:2=0.9;②气体总质量不变,总物质的量减小,故平均相对分子质量增加。
2Z;(2)2分钟时,物质的量增加了0.2mol,浓度变化量为0.1mol/L,除以时间2分钟,即得该时间内的平均反应速率;(3)①体积不变的情况下,容器内的压强之比等于气体的物质的量之比,开始时容器内气体的总物质的量为X:1mol、Y:1mol,共2mol,2分钟后:X:0.9mol、Y:0.7mol、Z:0.2mol,共1.8mol,故压强之比是1.8:2=0.9;②气体总质量不变,总物质的量减小,故平均相对分子质量增加。
练习册系列答案
 名题金卷系列答案
名题金卷系列答案
相关题目
 2C的反应来说,以下化学反应速率的表示中,反应速率最快的是
2C的反应来说,以下化学反应速率的表示中,反应速率最快的是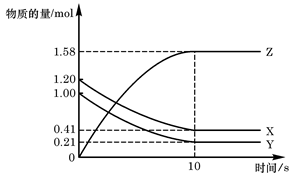
 Z(g)
Z(g)
 2NH3的化学平衡常数K = (保留两位小数)。
2NH3的化学平衡常数K = (保留两位小数)。 N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是