题目内容
【题目】工业上,常采用氧化还原方法处理尾气中的CO、NO。
(氧化处理法)沥青混凝土可作为反应:2CO(g)+O2(g)![]() 2CO2(g)的催化剂。
2CO2(g)的催化剂。
图甲表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
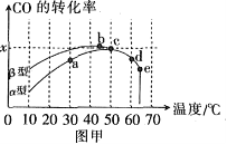
(1)在a、b、c、d四点中,未达到平衡状态的是___。
(2)已知c点时容器中O2浓度为0.04mol·L-1,则50℃时,在α型沥青混凝土中CO转化反应的平衡常数K=___(用含x的代数式表示)。
(3)下列关于图甲的说法正确的是__。
A.CO转化反应的平衡常数K(a)<K(c)
B.在均未达到平衡状态时,同温下β型沥青混凝土中CO转化速率比α型要大
C.b点时CO与O2分子之间发生有效碰撞的几率在整个实验过程中最高
D.e点转化率出现突变的原因可能是温度升高后催化剂失去活性
(还原处理法)某含钴催化剂可以催化消除柴油车尾气中的碳烟(C)和NOx。不同温度下,将模拟尾气(含0.025molNO、0.5molO2和足量碳烟)以相同的流速通过该催化剂,测得所有产物(CO2、N2、N2O)与NO的相关数据,结果如图乙所示。
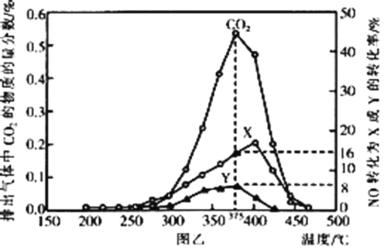
(4)375℃时,测得排出的气体中含0.45molO2和0.052molCO2,则Y的化学式为___。
(5)实验过程中采用NO模拟NOx,而不采用NO2的原因是___。
(6)工业上常用高浓度的K2CO3溶液吸收CO2,再利用电解法使K2CO3溶液再生,其装置示意图如图:
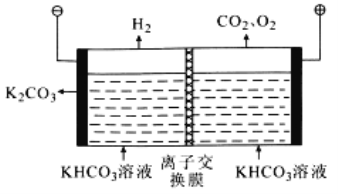
①在阳极区发生的反应包括___和H++HCO3- =CO2↑+H2O
②简述CO32-在阴极区再生的原理:___。
【答案】a ![]() BD N2O 由于存在反应2NO2
BD N2O 由于存在反应2NO2![]() N2O4会导致一定的分析误差 4OH--4e-═2H2O+O2↑(或2H2O-4e-=4H++O2↑) HCO3- 与阴极水电解所生成的OH-反应(或结合)生成CO32-
N2O4会导致一定的分析误差 4OH--4e-═2H2O+O2↑(或2H2O-4e-=4H++O2↑) HCO3- 与阴极水电解所生成的OH-反应(或结合)生成CO32-
【解析】
(1)图象分析可知b点反应达到平衡状态,升温平衡逆向进行;
(2)列出三段式,根据平衡常数K=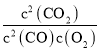 进行计算;
进行计算;
(3)根据图象结合影响平衡的因素进行分析;
(4)根据氮原子守恒和氧原子守恒进行计算;
(5)二氧化氮与四氧化二氮之间存在双聚平衡,所以无纯的二氧化氮;
(6)①阳极区还原剂失电子发生氧化反应,首先是水电离的OH-失电子生成O2,产生的H+又与HCO3-反应生成CO2;
②阴极区电极反应:4H2O+4e-=4OH-+2H2↑,OH-+HCO3-=CO32-。
(1)由图象分析可知b点反应达到平衡状态,升温平衡逆向进行,a、b、c、d 四点中,达到平衡状态的是bcd,在a、b、c、d四点中,未达到平衡状态的是a。故答案为:a;
(2)已知c点时容器中O2浓度为0.04mol·L-1,则50℃时,在α型沥青混凝土中CO转化反应:CO的降解率为x,设起始CO浓度为1mol·L-1,
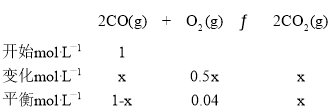
平衡常数K=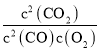 =
= =
=![]() (用含x的代数式表示)。故答案为:
(用含x的代数式表示)。故答案为:![]() ;
;
(3)A.平衡常数是温度的函数,温度升高向吸热方向进行,即向逆反应方向进行,K=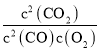 ,故K减小,CO转化反应的平衡常数K(a)>K(c)
,故K减小,CO转化反应的平衡常数K(a)>K(c)
B.由图可知,相同温度下β型沥青混凝土中CO降解速率比α型要大,故B正确;
C.a点的数据反映出CO降解率是整个实验过程中最高的,故C错误;
D.d点降解率出现突变,e点转化率变小的原因可能是温度升高后催化剂失去活性,故D正确;
故答案为:BD;
(4)模拟尾气中一氧化氮的物质的量为:0.25%×10mol=0.025mol,而图中参与反应生成X和Y的一氧化氮的物质的量为:0.025mol×(8%+16%)=0.006mol,模拟尾气中O2的物质的量为:10mol×5%=0.5mol,测得排出的气体中含0.45 mol O2,说明实际参与反应的氧气的物质的量为0.05mol,同时测得0.0525 mol CO2,根据氧守恒,可知一氧化二氮的物质的量为:0.05×2+0.006-0.0525×2=0.001mol,根据氮守恒可知氮气的物质的量为:![]() =0.002mol,所以16%对应的是氮气,而8%对应是一氧化二氮,即Y对应是N2O,故答案为:N2O;
=0.002mol,所以16%对应的是氮气,而8%对应是一氧化二氮,即Y对应是N2O,故答案为:N2O;
(5)二氧化氮与四氧化二氮之间存在双聚平衡,所以无纯的二氧化氮,NO较NO2稳定,NO2气体中存在N2O4,不便于定量测定,实验过程中采用NO模拟NOx,而不采用NO2的原因是由于存在反应2NO2![]() N2O4会导致一定的分析误差。故答案为:由于存在反应2NO2
N2O4会导致一定的分析误差。故答案为:由于存在反应2NO2![]() N2O4会导致一定的分析误差;
N2O4会导致一定的分析误差;
(6)①阳极区还原剂失电子发生氧化反应,首先是水电离的OH-失电子生成O2,产生的H+又与HCO3-反应生成CO2,在阳极区发生的反应包括4OH--4e-═2H2O+O2↑(或2H2O-4e-=4H++O2↑)和H++HCO3-=CO2↑+H2O,故答案为:4OH--4e-═2H2O+O2↑(或2H2O-4e-=4H++O2↑);
②阴极区电极反应:4H2O+4e-=4OH-+2H2↑,OH-+HCO3-=CO32- ,CO32-在阴极区再生的原理:HCO3-与阴极水电解所生成的OH-反应(或结合)生成CO32-。故答案为:HCO3-与阴极水电解所生成的OH-反应(或结合)生成CO32-。

 名校课堂系列答案
名校课堂系列答案【题目】高炉炼铁过程中发生的主要反应为:![]() ,已知该反应在不同温度下的平衡常数如下:
,已知该反应在不同温度下的平衡常数如下:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
请回答下列问题:
(1)该反应的平衡常数表达式![]() ______,该反应的正反应是______反应(填“放热”、“吸热”)。
______,该反应的正反应是______反应(填“放热”、“吸热”)。
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10 min后达到平衡。求该时间范围内反应的平均反应速率![]() ______、CO的平衡转化率
______、CO的平衡转化率![]() ______;
______;
(3)欲提高(2)中CO的平衡转化率,可采取的措施是______。
a.减少Fe的量 b.增加Fe2O3的量 c.移出部分CO2 d.提高反应温度e.减小容器的容积 f.加入合适的催化剂
(4)在氯氧化法处理含![]() 的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
①某厂废水中含KCN,其浓度为650mg/L。现用氯氧化法处理,发生如下反应(其中N均为![]() 价):
价):![]() 被氧化的元素是______。
被氧化的元素是______。
②投入过量液氯,可将氰酸盐进一步氧化为氮气。请配平下列化学方程式,并标出电子转移方向和数目:
□![]() □
□![]() □
□![]() □
□![]() □
□![]() □
□![]() □
□![]() ______
______
③若处理上述废水40L,使KCN完全转化为无毒物质,至少需液氯______g。
【题目】“绿水青山就是金山银山”,因此研究NOx、SO2等大气污染物的妥善处理具有重要意义。
(1)亚硝酰氯(Cl—N=O)气体是有机合成的重要试剂,它可由Cl2和NO在通常条件下反应制得,该反应的热化学方程式为__。
相关化学键的键能如下表所示:
化学键 | Cl—Cl | N | Cl—N | N=O |
键能/(kJ·mol-1) | 243 | 630 | 200 | 607 |
(2)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g)![]() 2CaSO4(s)+2CO2(g) ΔH=-681.8kJ·mol-1,对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
2CaSO4(s)+2CO2(g) ΔH=-681.8kJ·mol-1,对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时间/min 浓度/mol·L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10min内,平均反应速率v(CO2)=___mol·L-1·min-1;当升高温度,该反应的平衡常数K__(填“增大”、“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是__(填字母)。
A.加入一定量的粉状碳酸钙
B.适当缩小容器的体积
C.通入一定量的O2
D.加入合适的催化剂
(3)NOx的排放主要来自于汽车尾气,有人利用反应C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=-34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g) ΔH=-34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
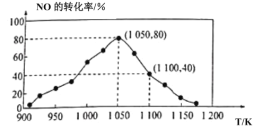
由图可知,1050K前反应中NO的转化率随温度升髙而增大,其原因为__。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=__[已知:气体分压(P分)=气体总压(Pa)×体积分数]
(4)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,生成无毒的N2和CO2实验测得,v正=k正c2(NO)·c2(CO),v逆=k逆c(N2) c2(CO2)(k正、k逆为速率常数,只与温度有关)。
N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,生成无毒的N2和CO2实验测得,v正=k正c2(NO)·c2(CO),v逆=k逆c(N2) c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅降低温度,k正减小的倍数_(填“>”、“<”或“=”)k逆减小的倍数。
②若在1L的密闭容器中充入1molCO和1molNO,在一定温度下达到平衡时,CO的转化率为20%,则![]() =__(计算结果用分数表示)
=__(计算结果用分数表示)
【题目】从下列实验事实所得出的相应结论不正确的是( )
选项 | 实验事实 | 结论 |
A | 其他条件不变,0.01mol·L-1的酸性KMnO4溶液分别与0.1mol·L-1的H2C2O4溶液和0.2mol·L-1的H2C2O4溶液反应,后者退色时间短 | 当其他条件不变时,增大反应物浓度可以使化学反应速率加快 |
B | 其他条件不变,分别将等体积、等物质的量浓度的Na2S2O3溶液和硫酸溶液的混合液放在冷水和热水中,放在热水中的混合液先出现浑浊 | 当其他条件不变时,反应体系的温度越高,化学反应速率越快 |
C | 一定条件下,分别在容积为1L和容积为2L的两个密闭容器中加入等量的氢气和碘蒸气,相同温度下发生如下反应:H2(g)+I2(g) | 当其他条件不变时,纯气态反应体系的压强越大,化学反应速率越快 |
D | 将少量MnO2粉末加入盛有10%H2O2溶液的锥形瓶内,在化学反应前后,MnO2的质量和化学性质都没有发生变化 | 催化剂虽然可以加快化学反应的速率,但一定不参与化学反应 |
A.AB.BC.CD.D