��Ŀ����
����Ŀ����¯���������з�������Ҫ��ӦΪ��![]() ����֪�÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�����£�
����֪�÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�����£�
�¶�/�� | 1000 | 1150 | 1300 |
ƽ�ⳣ�� | 4.0 | 3.7 | 3.5 |
��ش��������⣺
��1���÷�Ӧ��ƽ�ⳣ������ʽ![]() ______���÷�Ӧ������Ӧ��______��Ӧ������ȡ��������ȡ�����
______���÷�Ӧ������Ӧ��______��Ӧ������ȡ��������ȡ�����
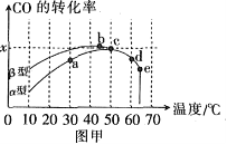
��2����һ���ݻ�Ϊ10L���ܱ������У�1000��ʱ����Fe��Fe2O3��CO��CO2��1.0mol����Ӧ����10 min��ﵽƽ�⡣���ʱ�䷶Χ�ڷ�Ӧ��ƽ����Ӧ����![]() ______��CO��ƽ��ת����
______��CO��ƽ��ת����![]() ______��
______��
��3������ߣ�2����CO��ƽ��ת���ʣ��ɲ�ȡ�Ĵ�ʩ��______��
a.����Fe���� b.����Fe2O3���� c.�Ƴ�����CO2 d.��߷�Ӧ�¶�e.��С�������ݻ� f.������ʵĴ���
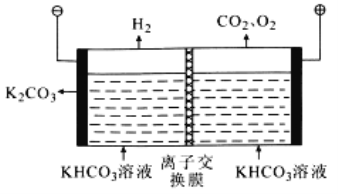
��4������������������![]() �ķ�ˮ�����У�Һ���ڼ��������¿��Խ��軯�������������Σ��䶾�Խ�Ϊ�軯���ǧ��֮һ���������ν�һ��������Ϊ�����ʡ�
�ķ�ˮ�����У�Һ���ڼ��������¿��Խ��軯�������������Σ��䶾�Խ�Ϊ�軯���ǧ��֮һ���������ν�һ��������Ϊ�����ʡ�
��ij����ˮ�к�KCN����Ũ��Ϊ650mg/L���������������������������·�Ӧ������N��Ϊ![]() �ۣ���
�ۣ���![]() ��������Ԫ����______��
��������Ԫ����______��
��Ͷ�����Һ�ȣ��ɽ������ν�һ������Ϊ����������ƽ���л�ѧ����ʽ�����������ת�Ʒ������Ŀ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ______
______
��������������ˮ40L��ʹKCN��ȫת��Ϊ�����ʣ�������Һ��______g��
���𰸡�![]() ����
���� ![]() 80% c KCN�е�CԪ��
80% c KCN�е�CԪ��  71
71
��������
(1)K=![]() ���¶����ߣ�K��С��˵���¶����ߣ�ƽ�������ƶ����淴ӦΪ���ȷ�Ӧ������ӦΪ���ȷ�Ӧ���ʴ�Ϊ��
���¶����ߣ�K��С��˵���¶����ߣ�ƽ�������ƶ����淴ӦΪ���ȷ�Ӧ������ӦΪ���ȷ�Ӧ���ʴ�Ϊ��![]() �����ȣ�
�����ȣ�
(2)��ƽ��ʱCO2��Ũ��Ϊx����CO��Ũ�ȼ�Сx��Ϊ![]() mol/L-x=0.1mol/L-x����K=4.0=
mol/L-x=0.1mol/L-x����K=4.0=![]() ����ã�x=0.08mol/L����
����ã�x=0.08mol/L����![]()
![]() =
=![]() ��CO��ƽ��ת����=
��CO��ƽ��ת����=![]() =80%��
=80%��
(3)a�����ٹ��������ƽ�ⲻ�ƶ���CO��ת���ʲ��䣬a����
b�����ӹ��������ƽ�ⲻ�ƶ���CO��ת���ʲ��䣬b����
c���Ƴ�����CO2��CO2��Ũ�ȼ�С��ƽ�������ƶ���CO��ת��������c��ȷ��
d����߷�Ӧ�¶ȣ�ƽ�ⳣ����С��CO��ת���ʼ�С��d����
e����С�ݻ�����ƽ�ⲻ�ƶ���CO��ת���ʲ��䣬e����
f��������������̵���ƽ���ʱ�䣬���Dz���ʹƽ�ⷢ���ƶ���CO��ת���ʲ��䣬f����
�ʴ�Ϊ��c��
(4)��KCN�е�CΪ+2�ۣ�KOCN�е�CΪ+4�ۣ�����KCN�е�CԪ�ر��������ʴ�Ϊ��KCN�е�CԪ�أ�
��1molCl2���뷴Ӧ��2mol���ӣ�KOCN����1molN2ʧ6mol���ӣ����ݵ�ʧ�����غ㣬����������ƽ��2![]() ~3Cl2~1N2~6KCl���ٸ���ԭ���غ�������ƽ����ԭ�ӣ����£�
~3Cl2~1N2~6KCl���ٸ���ԭ���غ�������ƽ����ԭ�ӣ����£�![]() �������ű�ʾ����ת�����£�
�������ű�ʾ����ת�����£�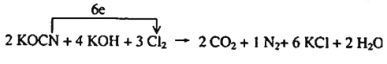 ���ʴ�Ϊ��
���ʴ�Ϊ��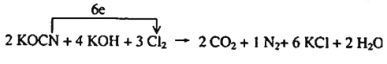 ��
��
�۸÷�����CN-������ΪN2�������¹�ϵ��2KCN~2![]() ~(2+3)Cl2��KCN������m=650mg/L��40L=26000mg=26g��
~(2+3)Cl2��KCN������m=650mg/L��40L=26000mg=26g��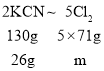 ����ã�m=71g���ʴ�Ϊ��71��
����ã�m=71g���ʴ�Ϊ��71��