题目内容
6.卤族元素的单质和化合物很多,请用物质结构与性质的相关知识回答:(1)在一定浓度的溶液中,存在(HF)n缔合分子,使HF分子缔合的作用力氢键.
(2)ClO4-中氯原子的杂化方式为sp3,离子的立体构型为正四面体;
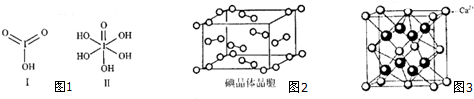
(3)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图1I、II所示:请比较酸性强弱:HIO3> H5IO6(填“>”、“<”或“=”).H5IO6分子中σ键与π键的个数比为11:1.
(4)如图2为碘晶体晶胞结构,有关说法中正确的是BC.
A、用均摊法可知平均每个晶胞中有4个碘原子
B、碘晶体为分子的配位数为12,具有分子密堆积特征
C、碘晶体中存在的相互作用有非极性键和范德华力
D、碘晶体中碘分子有3种排列方向
(5)观察CaF2晶胞结构,判断F-占据Ca2+形成的四面体空隙中,Ca2+占据F-形成的六面体空隙中,若相邻的两个Ca2+的核间距为acm,晶胞密度为pg/cm3,NA为阿伏伽德罗常数,则CaF2的摩尔质量可以表示为$\frac{\sqrt{2}}{2}{a}^{3}ρ{N}_{A}$g/mol.
分析 (1)氟化氢、水和氨气中都存在氢键;
(2)该离子中价层电子对个数是4且不含孤电子对,利用价层电子对互斥理论判断Cl原子杂化方式及空间构型;
(3)含氧酸中,非羟基O原子个数越多,其酸性越强;共价单键为σ键、共价双键中含有σ键、π键;
(4)A.该晶胞中碘分子个数为4,每个分子含有两个碘原子;
B.碘晶胞中配位数=3×8÷2;
C.碘是分子晶体,分子之间存在范德华力,同种非金属元素之间易形成非极性键;
D.碘晶胞中存在一种排列方式;
(5)根据图知,每个氟离子连接4个钙离子,四个钙离子形成正四面体结构;每个钙离子连接8个氟离子,8个氟离子形成正六面体结构;该晶胞中氟离子个数为8、钙离子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,若相邻的两个Ca2+的核间距为acm,则晶胞棱长=$\sqrt{2a}$cm,晶胞体积=($\sqrt{2a}$cm)3,晶胞摩尔质量M=$\frac{ρV{N}_{A}}{4}$.
解答 解:(1)氟化氢、水和氨气中都存在氢键,氢键的存在导致HF分子之间缔合形成缔合分子,故答案为:氢键;
(2)ClO4-中氯原子价层电子对个数是4且不含孤电子对,所以Cl原子的杂化方式为sp3,离子的立体构型为正四面体,故答案为:sp3;正四面体形;
(3)含氧酸中,非羟基O原子个数越多,其酸性越强,碘酸中非羟基氧原子个数大于高碘酸,所以酸性HIO3>H5IO6;共价单键为σ键、共价双键中含有σ键、π键,则H5IO6分子中σ键与π键的个数比为11:1,
故答案为:>;11:1;
(4)A、用均摊法可知平均每个晶胞中有4个碘分子,每个碘分子含有两个I原子,所以每个晶胞中含有8个I原子,故错误;
B、碘晶胞中配位数=3×8÷2=12,具有分子密堆积特征,故正确;
C、碘晶体属于分子晶体,分子之间存在范德华力,相邻原子之间存在非极性键,故正确;
D、碘晶体中碘分子有1种排列方向,故错误;
故选BC;
(5)根据图知,每个氟离子连接4个钙离子,四个钙离子形成正四面体结构;每个钙离子连接8个氟离子,8个氟离子形成正六面体结构;该晶胞中氟离子个数为8、钙离子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,若相邻的两个Ca2+的核间距为acm,则晶胞棱长=$\sqrt{2a}$cm,晶胞体积=($\sqrt{2a}$cm)3,晶胞摩尔质量M=$\frac{ρV{N}_{A}}{4}$=$\frac{ρ(\sqrt{2})^{3}{N}_{A}}{4}$g/mol=$\frac{\sqrt{2}}{2}{a}^{3}ρ{N}_{A}$g/mol,
故答案为:四;六;$\frac{\sqrt{2}}{2}{a}^{3}ρ{N}_{A}$.
点评 本题考查物质结构和性质,涉及晶胞计算、原子杂化方式判断、微粒空间构型、氢键等知识点,为高频考点,利用均摊法、价层电子对互斥理论等知识点分析解答,难点是(5)题晶胞计算.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案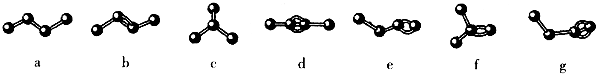
| A. | 只含4个碳原子的烃中,碳原子间的相互结合方式共有如图所示七种情况 | |
| B. | 以上七种物质均属于烷烃 | |
| C. | c和f分子的空间构型相同 | |
| D. | d与g互为同分异构体 |
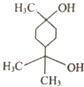
| A. | 4种 | B. | 5种 | C. | 8种 | D. | 9种 |
| 1 | 2 | 3 | 4 | 5 | 6 | … |
| CH4O | C2H6O | C3H8O | C5H12O | C6H14O | … |
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
| A. | 标准状况下22.4L氯气通入足量水中反应,转移的电子数为NA | |
| B. | 乙烯和氮气组成的28g混合气体中含有NA个分子 | |
| C. | 1molNa2O2中阳离子和阴离子数均为2NA | |
| D. | 1molFeCl3跟水完全反应转化为氢氧化铁胶体后,其中胶体粒子的数目为NA |
| A. | 水的离子积KW只与温度有关,但水的电离程度一定会受外加酸、碱、盐的影响 | |
| B. | 若HA的Ka=1.7×10-5,BOH的Kb=1.7×10-5,则HA溶液中的c(H+)与BOH中的c(OH-)相等 | |
| C. | 将0.2mol/L HA溶液和0.1mol/L NaOH溶液等体积混合,则反应后的混合液中:c(OH-)+c(A-)=c(H+)+c(HA) | |
| D. | Mg(OH)2能溶于NH4Cl浓溶液的主要原因是NH4+结合OH-使沉淀溶解平衡发生正向移动 |
 ;
;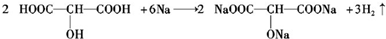 ;
;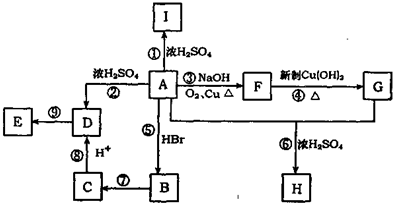
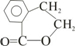 ;
;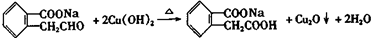 ;写出反应⑦的化学方程式
;写出反应⑦的化学方程式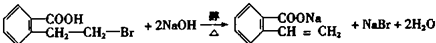 ;
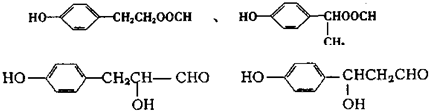
;
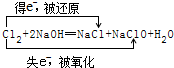
 .
.