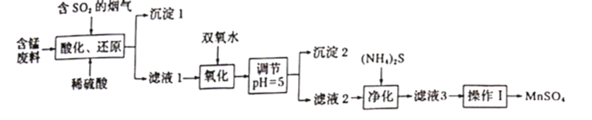
题目内容
【题目】工业上用软锰矿及含锰废料(主要成分![]() ,含有少量
,含有少量![]() 等)与烟气脱硫进行联合处理并制备
等)与烟气脱硫进行联合处理并制备![]() 的流程如下:
的流程如下:
25℃时,几种金属离子沉淀时的pH如下:
|
|
|
|
| |
开始沉淀时pH | 7.6 | 2.7 | 3.8 | 8.3 | 5.9 |
完全沉淀时pH | 9.7 | 4.0 | 4.7 | 9.8 | 6.9 |
(1)![]() 在酸化还原步骤中所发生反应的离子方程式分别为_____________、_____________。
在酸化还原步骤中所发生反应的离子方程式分别为_____________、_____________。
(2)沉淀1为_________(填化学式),用双氧水处理滤液1时,通常在40~55℃下进行原因是_____________。
(3)氧化反应过程中常会有一定量的气泡产生,可能的原因是___________,调节溶液![]() 的目的是_______________
的目的是_______________
(4)“净化”时,加入![]() 的作用是______________
的作用是______________
(5)滤液3中除![]() 外,还含有少量
外,还含有少量![]() 。
。![]() 的溶解度曲线如图所示。据此判断,“操作I”应为___________、______、洗涤、干燥。
的溶解度曲线如图所示。据此判断,“操作I”应为___________、______、洗涤、干燥。

【答案】![]()
![]()
![]() 温度过高双氧水分解,温度过低反应速率太慢 在
温度过高双氧水分解,温度过低反应速率太慢 在![]() 以及氧化生成的Fe3+的催化作用下,双氧水发生分解,生成氧气 使
以及氧化生成的Fe3+的催化作用下,双氧水发生分解,生成氧气 使![]() 转化为
转化为![]() 将
将![]() 转化为
转化为![]() 沉淀 蒸发结晶 趁热过滤
沉淀 蒸发结晶 趁热过滤
【解析】
含锰废料中的杂质有氧化铁,氧化铝,氧化钙,氧化铜以及二氧化硅;以软锰矿为原料,通过与烟气脱硫联合处理的办法制备最终产品为硫酸锰,那么制备过程中的Fe,Al,Ca,Cu以及Si等杂质元素要除去;第一步将原料加硫酸处理,由于SiO2不溶于硫酸,所以沉淀1中必然含有SiO2,又因为CaSO4溶解性较差,所以沉淀1中也含有CaSO4;那么滤液中剩余的杂质元素为Al,Fe,Cu;由于第一步加酸溶解时,同时溶液中也在不断地通入还原性气体SO2,那么滤液1中的Fe元素有些为+2价;为了除Fe和Al,需要先用氧化剂将Fe元素全部转化为Fe3+后再调节溶液pH值,使Fe,Al转化为沉淀除去;为了避免引入新杂质,氧化剂选用的是双氧水,其性质不稳定受热易分解,因此要避免温度过高;这样,滤液2中的杂质元素仅为Cu,通过向滤液中加入(NH4)2S,将其转化为CuS沉淀即可除去;最终的滤液3中除硫酸锰外还含有少量的硫酸铵,结合二者溶解度随温度的变化曲线,通过蒸发结晶和趁热过滤的方法即可获得纯度较高的硫酸锰固体,再对其进行洗涤干燥即可。
(1)MnO2在酸化还原后转化为Mn2+,Fe2O3在酸化还原后转化为Fe2+,相关的离子方程式分别为:![]() 和
和![]() ;
;
(2)通过分析可知,沉淀1中有不与硫酸反应的SiO2以及溶解性较差的CaSO4;双氧水性质不稳定,受热易分解,因此用其处理滤液1时,温度控制在40至55℃之间是一方面是为了避免双氧水在较高温度下分解,另一方面也为了避免温度过低导致的反应速率过慢;
(3)氧化步骤会将Fe2+氧化为Fe3+,此外溶液中还存在Cu2+和Mn2+均能催化过氧化氢分解,产生氧气;通过分析可知,调节pH=5是为了将Fe3+和Al3+转化为沉淀除去;
(4)通过分析可知,净化步骤为了除去溶液中剩余的杂质Cu2+;通过加入硫化铵,可将Cu2+转化为CuS沉淀除去;
(5)由硫酸锰和硫酸铵的溶解度曲线可知,溶液温度高于30℃左右时,硫酸铵溶解度持续增大而硫酸锰的溶解度反而下降;因此为了从滤液3中获得纯度较高的硫酸锰,可采用蒸发结晶,趁热过滤的方式,再对过滤得到的硫酸锰进行洗涤,干燥即可。

【题目】过氧乙酸又名过醋酸![]() ,是重要化工原料,也是一种绿色生态杀菌剂,其制法为
,是重要化工原料,也是一种绿色生态杀菌剂,其制法为![]() 。
。
(1)某同学写出了碳原子的4种不同状态的电子排布图:
a.![]() b.
b.![]()
c.![]() d.
d.![]()
其中能量最低的是________(填标号),电子由状态C到状态B所得到的光谱为________光谱(填“原子发射”或“原子吸收”)。
(2)过氧乙酸分子中C原子的杂化方式有________。
(3)乙酸比乙醇易电离出![]() 的原因____________________。
的原因____________________。
(4)熔点:乙酸________硝酸(填“>”、“<”或“=”),理由_________________。
(5)造纸中,用![]() 与纸浆中的过氧乙酸以及过渡金属离子反应以提高漂白效率。硼氢化钠、硼氢化铝被认为是有机化学上的“万能还原剂”。
与纸浆中的过氧乙酸以及过渡金属离子反应以提高漂白效率。硼氢化钠、硼氢化铝被认为是有机化学上的“万能还原剂”。
①两种硼氢化物的熔点如下表所示:
硼氢化物 |
|
|
熔点/℃ | 400 | -64.5 |
解释表中两种物质熔点差异的原因________。
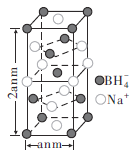
②硼氢化钠晶胞结构如图所示,该晶体中![]() 的配位数为________。已知:硼氢化钠晶体的密度为
的配位数为________。已知:硼氢化钠晶体的密度为![]() ,
,![]() 代表阿伏伽德罗常数的值,则a=________nm(用含
代表阿伏伽德罗常数的值,则a=________nm(用含![]() 、
、![]() 的最简式子表示)。
的最简式子表示)。
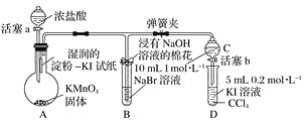
【题目】下图为探究铝片和![]() 溶液反应的实验方案及现象。下列说法错误的是( )
溶液反应的实验方案及现象。下列说法错误的是( )
|
| |
无明显现象 | 铝片表面产生细小气泡 | 出现白色浑浊,产生大量气泡(经检验为 |
A.![]() 溶液显碱性的原因:
溶液显碱性的原因:![]()
B.加热和![]() 逸出对
逸出对![]() 水解平衡移动方向的影响是相反的
水解平衡移动方向的影响是相反的
C.对比实验I、Ⅲ,说明![]() 溶液能破坏铝表面的氧化膜
溶液能破坏铝表面的氧化膜
D.推测出现的白色沉淀可能是氢氧化铝
【题目】将不同量的CO(g)和H2O(g)分别通入体积为2 L的恒容密闭容器中,进行反应:CO(g) + H2O(g) ![]() CO2(g) + H2(g),得到如下三组数据:
CO2(g) + H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
CO | H2O | CO2 | |||
1 | 650 | 4 | 2 | 1.6 | 5 |
2 | 900 | 2 | 1 | 0.4 | 3 |
3 | 2 | 1 | 0.4 | 1 | |
下列说法不正确的是
A. 该反应的正反应为放热反应
B. 实验1中,前5min用CO表示的速率为0.16 mol/(L·min)
C. 实验2中,平衡常数K=1/6
D. 实验3跟实验2相比,改变的条件可能是温度