题目内容
【题目】草酸亚铁晶体(![]() )常用于晒制蓝图。某研究性学习小组对其进行了系列探究。
)常用于晒制蓝图。某研究性学习小组对其进行了系列探究。
I.纯净的草酸亚铁晶体热分解产物的探究
(1)气体产物成分的探究,小组成员采用如下装置(可重复选用)进行实验:

①E中盛装碱石灰的仪器名称为__________________。
②按照气流从左到右的方向,上述装置的接口顺序为![]() ___________尾气处理装置。
___________尾气处理装置。
③实验前先通入一段时间![]() ,其目的是________________________。
,其目的是________________________。
④实验证明气体产物中含有![]() ,依据的实验现象为_________________________________。
,依据的实验现象为_________________________________。
(2)![]() 受热分解时,固体质量随温度变化的曲线如下图所示,写出加热到400℃时,
受热分解时,固体质量随温度变化的曲线如下图所示,写出加热到400℃时,![]() 晶体受热分解的化学方程式_________________________。
晶体受热分解的化学方程式_________________________。

(3)晒制蓝图时,以![]() 溶液为显色剂,写出
溶液为显色剂,写出![]() 与
与![]() 溶液反应的化学方程式____________。
溶液反应的化学方程式____________。
Ⅱ.草酸亚铁晶体样品纯度的测定
(4)工业制得的草酸亚铁晶体中常含有![]() 杂质测定其纯度的步骤如下:
杂质测定其纯度的步骤如下:
步骤1:称取![]() 草酸亚铁晶体样品溶于稀
草酸亚铁晶体样品溶于稀![]() 中,配成
中,配成![]() 溶液;
溶液;
步骤2:取上述溶液![]() ,用
,用![]() ,标准液滴定至终点消耗标准液
,标准液滴定至终点消耗标准液![]() ;
;
步骤3:向反应后溶液中加入适量锌粉充分反应后加人适量稀![]() ,再用
,再用![]() 标准液滴定至终点,消耗标准液
标准液滴定至终点,消耗标准液![]()
①步骤2中滴定终点的现象为_______________,,步骤3中加入锌粉的目的是__________________。
②草酸亚铁晶体样品的纯度为_________________(写出计算表达式)。
【答案】U形管 ![]() 排出装置中的空气,防止加热时爆炸 C处反应管中的固体由黑变红,其后的澄清石灰水变浑浊
排出装置中的空气,防止加热时爆炸 C处反应管中的固体由黑变红,其后的澄清石灰水变浑浊 ![]() (或
(或![]() )
) ![]() 当加入最后1滴
当加入最后1滴![]() 溶液时,溶液变为浅红色,且半分钟内不恢复原色 将
溶液时,溶液变为浅红色,且半分钟内不恢复原色 将![]() 还原为
还原为![]()

【解析】
Ⅰ由草酸亚铁晶体的化学式推测,其隔绝空气受热分解时可能会产生FeO,水以及碳的氧化物;可利用CO的还原性验证生成的碳的氧化物中含有CO,那么C装置与其后放置的B装置组合,即可起到验证CO生成的作用;由于CO属于可燃气体,为了避免可能发生的危险,需要在加热前通氮气,将装置内的空气驱赶走;在考虑装置的连接顺序时,由于C装置是在硬质玻璃管中对固体进行加热,因此入口处务必要加干燥装置,防止水蒸气进入C装置导致其炸裂,这样C装置前方务必为E装置;此外,为了验证分解产物也有CO2,需要在E的前方也放置一个B装置。
Ⅱ由于工业制得的草酸亚铁晶体中的杂质为FeSO4,因此,是由草酸根的含量确定的草酸亚铁产物的纯度;为了确定草酸根的含量,题干设计了两次滴定实验即分别为步骤2和步骤3;步骤2中,样品溶液中的Fe2+和草酸根都被高锰酸钾氧化,Fe2+被氧化为Fe3+仍留在溶液中,而草酸根则被氧化为CO2从溶液中消失;步骤3中,先用锌粉将步骤2生成的Fe3+转化为Fe2+,再用高锰酸钾溶液将Fe2+又氧化为Fe3+;由于步骤2和3使用的高锰酸钾溶液浓度相同,那么步骤2相比于步骤3多加的高锰酸钾溶液则用于将草酸根氧化,再进一步根据电子得失守恒即可确定草酸根的含量,草酸亚铁产品的纯度即可计算。
Ⅰ(1)①由E装置的形状可知,其名称为U形管或U形干燥管;
②通过分析可知,C装置前方务必加干燥装置E,B装置要与C装置一同构成验证CO产物生成的组合装置,此外也需要在验证CO的生成的装置前方安排验证CO2生成的B装置;因此连接顺序为a→g→f→b→c→h→i→d→e→b→c→尾气处理装置;
③通过分析可知,由于草酸亚铁分解时会产生可燃气体CO,因此加热前需要用氮气将装置内的空气排尽,防止加热时发生爆炸;
④通过分析可知,若有CO生成,则C装置中的CuO会被还原为Cu单质,即固体由黑色变为红色;B装置则会因为C中产生的CO2而出现浑浊现象;
(2)通过分析可知,草酸亚铁晶体分解时会生成水,CO和CO2;结合固体质量随温度变化的曲线,进一步可知,草酸亚铁晶体分解时先发生的是结晶水的脱除,随后再发生草酸亚铁的分解,因此加热到400℃时发生的化学方程式为:![]() 或
或![]() ;
;
(3)草酸亚铁中的Fe为+2价,可以与铁氰化钾反应生成蓝色沉淀,相应的化学方程式为:![]() ;
;
Ⅱ(4)①通过分析可知,步骤2发生的是高锰酸钾将Fe2+和草酸根氧化的反应;步骤2滴定终点的现象为:加入最后一滴高锰酸钾溶液后,溶液变为浅红色,且半分钟内不变化;步骤3中加入锌粉是为了将步骤2中生成的Fe3+还原为Fe2+;
②通过分析可知,mg草酸亚铁晶体样品配制成250mL溶液后,25mL这种溶液中含有的草酸根可以消耗的高锰酸钾溶液的物质的量为:![]() ;那么,结合电子得失守恒可知,mg样品中含有的草酸根的物质的量为:
;那么,结合电子得失守恒可知,mg样品中含有的草酸根的物质的量为:![]() ;草酸亚铁晶体的摩尔质量为180g/mol;所以样品的纯度为:
;草酸亚铁晶体的摩尔质量为180g/mol;所以样品的纯度为: 。
。

【题目】工业上用软锰矿及含锰废料(主要成分![]() ,含有少量
,含有少量![]() 等)与烟气脱硫进行联合处理并制备
等)与烟气脱硫进行联合处理并制备![]() 的流程如下:
的流程如下:
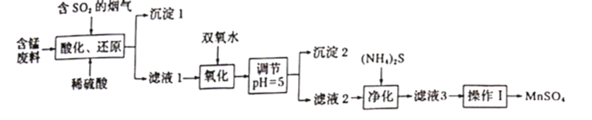
25℃时,几种金属离子沉淀时的pH如下:
|
|
|
|
| |
开始沉淀时pH | 7.6 | 2.7 | 3.8 | 8.3 | 5.9 |
完全沉淀时pH | 9.7 | 4.0 | 4.7 | 9.8 | 6.9 |
(1)![]() 在酸化还原步骤中所发生反应的离子方程式分别为_____________、_____________。
在酸化还原步骤中所发生反应的离子方程式分别为_____________、_____________。
(2)沉淀1为_________(填化学式),用双氧水处理滤液1时,通常在40~55℃下进行原因是_____________。
(3)氧化反应过程中常会有一定量的气泡产生,可能的原因是___________,调节溶液![]() 的目的是_______________
的目的是_______________
(4)“净化”时,加入![]() 的作用是______________
的作用是______________
(5)滤液3中除![]() 外,还含有少量
外,还含有少量![]() 。
。![]() 的溶解度曲线如图所示。据此判断,“操作I”应为___________、______、洗涤、干燥。
的溶解度曲线如图所示。据此判断,“操作I”应为___________、______、洗涤、干燥。