题目内容
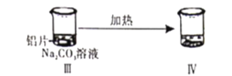
【题目】下图为探究铝片和![]() 溶液反应的实验方案及现象。下列说法错误的是( )
溶液反应的实验方案及现象。下列说法错误的是( )
|
| |
无明显现象 | 铝片表面产生细小气泡 | 出现白色浑浊,产生大量气泡(经检验为 |
A.![]() 溶液显碱性的原因:
溶液显碱性的原因:![]()
B.加热和![]() 逸出对
逸出对![]() 水解平衡移动方向的影响是相反的
水解平衡移动方向的影响是相反的
C.对比实验I、Ⅲ,说明![]() 溶液能破坏铝表面的氧化膜
溶液能破坏铝表面的氧化膜
D.推测出现的白色沉淀可能是氢氧化铝
【答案】B
【解析】
铝的化学性质活泼,因此铝片表面常常会附着致密的氧化物薄膜,这层薄膜会对内部的Al单质起到一定的保护作用;碳酸钠溶液显碱性主要因为碳酸根的水解,氧化铝是两性氧化物,因此铝片表面的氧化铝可以在碳酸钠溶液中溶解,进而碳酸钠溶液可以与内部的Al单质反应;由于Al单质与碳酸钠的反应,实质是Al在消耗碳酸根水解产生的OH-,这会导致碳酸根的水解平衡正向移动,进而产生氢气以及CO2气体。
A.碳酸根是多元弱酸的酸根离子,分步水解以第一步水解为主,因此碳酸钠溶液显碱性的原因为:![]() ,A项正确;
,A项正确;
B.盐类水解为吸热过程,加热可促进盐类的水解;氢气的逸出有利于铝和OH-的反应,OH-被消耗也会促进碳酸根离子的水解,所以加热和氢气逸出都会对![]() 的水解平衡起到促进作用,B项错误;
的水解平衡起到促进作用,B项错误;
C.实验Ⅲ中产生了气泡,说明Al单质发生了反应;Al单质由于性质活泼,表面往往会生成致密的氧化铝薄膜,从而使得内部的Al单质被保护;因此由现象可说明实验Ⅲ中铝片表面的氧化铝被碳酸钠溶液破坏掉了,C项正确;
D.碳酸钠溶液与Al单质反应,可将其转化为![]() ;由于碳酸根水解平衡被促进,导致溶液中含有较多的
;由于碳酸根水解平衡被促进,导致溶液中含有较多的![]() ,其可与
,其可与![]() 反应生成Al(OH)3白色沉淀,D项正确;
反应生成Al(OH)3白色沉淀,D项正确;
答案选B。

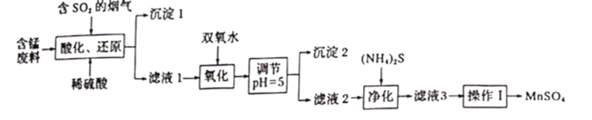
【题目】工业上用软锰矿及含锰废料(主要成分![]() ,含有少量
,含有少量![]() 等)与烟气脱硫进行联合处理并制备
等)与烟气脱硫进行联合处理并制备![]() 的流程如下:
的流程如下:
25℃时,几种金属离子沉淀时的pH如下:
|
|
|
|
| |
开始沉淀时pH | 7.6 | 2.7 | 3.8 | 8.3 | 5.9 |
完全沉淀时pH | 9.7 | 4.0 | 4.7 | 9.8 | 6.9 |
(1)![]() 在酸化还原步骤中所发生反应的离子方程式分别为_____________、_____________。
在酸化还原步骤中所发生反应的离子方程式分别为_____________、_____________。
(2)沉淀1为_________(填化学式),用双氧水处理滤液1时,通常在40~55℃下进行原因是_____________。
(3)氧化反应过程中常会有一定量的气泡产生,可能的原因是___________,调节溶液![]() 的目的是_______________
的目的是_______________
(4)“净化”时,加入![]() 的作用是______________
的作用是______________
(5)滤液3中除![]() 外,还含有少量
外,还含有少量![]() 。
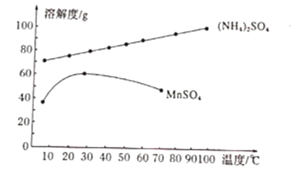
。![]() 的溶解度曲线如图所示。据此判断,“操作I”应为___________、______、洗涤、干燥。
的溶解度曲线如图所示。据此判断,“操作I”应为___________、______、洗涤、干燥。