��Ŀ����
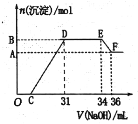
����Ŀ�������£���10 mL 0.1000 mol��L-1 NaOH��Һ����μ���0.1000 mol��L-1 ��ijһԪ��HX����ҺpH�仯������ͼ������˵������ȷ����
A.��Ũ�ȵ� HX��NaX �����Һ�У�HX�ĵ���̶ȴ���X- ��ˮ��̶�
B.c����ʾ��Һ�д��ڣ�2c(H+) - 2c(OH-) = c(X-) - c(HX)
C.a��b��c����ʾ��Һ�У���ˮ������� c(H+)��c(OH-) ֵ����
D.a ��c����ʾ��Һ�У�c(X-) + c(HX) + c(Na+) = 0.1000 mol��L-1 ʼ�ճ���
���𰸡�C
��������
A��c��Ϊ��Ũ�ȵ�HX��NaX�����Һ��HX�ĵ��������ԣ�X����ˮ���Լ��ԣ���ͼ��c���֪��pH��4.7�������ԣ�˵��HX�ĵ���̶ȴ���X����ˮ��̶ȣ���ȷ��A��ѡ��
B��c��Ϊ��Ũ�ȵ�HX��NaX�����Һ�����Ϲ�ϵΪc(X��)+c(HX)��2c(Na��)����ɹ�ϵΪc(X��)+c(OH��)��c(H��)+c(Na��)����ȥc(Na��)�õ�2c(H��)��2c(OH��)��c(X��)��c(HX)����ȷ��B��ѡ��
C��a������ΪNaX���ٽ�ˮ�ĵ��룬ˮ�������c(H��)��c(OH��)��10��7mol��L��1��b��Ϊ���Ե㣬ˮ�������c(H��)��c(OH��)��10��7mol��L��1��c������Ϊ��Ũ�ȵ�HX��NaX����HX�����H������ˮ�ĵ��룬ˮ�������c(H��)��c(OH��)��10��7mol��L��1������ˮ�������c(H��)��c(OH��)��С˳��Ϊa��b��c������ѡC��
D��a����ʾ��Һ�У�n(Na��)��10mL��10��3��0.1000mol��L��1��n(X��)+n(HX)��0.001mol��a��c����ʾ��Һ����һ���ټ���HX�����ΪVL�������HX���ʵ���Ϊ0.1V����Һ�����Ϊc(v+0.02)L������a��c����ʾ��Һ�У�c(X��)+c(HX)+c(Na��)��![]() ��0.1000 mol��L��1�����HX������أ���ȷ��D��ѡ��
��0.1000 mol��L��1�����HX������أ���ȷ��D��ѡ��
��ѡC��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��һ���¶��£��������ݻ���Ϊ2L�ĺ����ܱ������з�����Ӧ��CO(g) + Cl2(g) ![]() COCl2(g)������������5 minʱ����ƽ�⡣
COCl2(g)������������5 minʱ����ƽ�⡣
������� | �¶�/�� | ��ʼ���ʵ���/mol | ƽ�����ʵ���/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
�� | 500 | 4.0 | 4.0 | 0 | 3.2 |
�� | 500 | 4.0 | a | 0 | 2.0 |
�� | 600 | 2.0 | 2.0 | 2.0 | 2.8 |
����˵������ȷ����
A.a = 2.2 mol
B.��������ǰ5 min��ƽ����Ӧ����v(CO) = 0.08 mol��L-1��min-1
C.�÷�Ӧ��500��ʱ��ƽ�ⳣ��K = 5
D.����������ʼͶ��ΪCO 2.0 mol��Cl2 2.0 mol��ƽ��ʱCOת����С��80%
����Ŀ���¶�T��ʱ����3�������ͬ�ĺ����ܱ������з�����ӦCO(g)��H2O(g)![]() CO2(g)��H2(g)��H=��41kJ��mol��1������ʼʱͶ�ϡ������ʵ��������ƽ�������ϵ�����ı仯�����ʾ��
CO2(g)��H2(g)��H=��41kJ��mol��1������ʼʱͶ�ϡ������ʵ��������ƽ�������ϵ�����ı仯�����ʾ��
������� | ��ʼʱ���������ʵ���/mol | ��ƽ�������ϵ�����ı仯(��Ϊ��ֵ) | |||
CO | H2O(g) | CO2 | H2 | ||
�� | 1 | 4 | 0 | 0 | 32.8kJ |
�� | 8 | 2 | 0 | 0 | Q1 |
�� | 0 | 0 | 1 | 4 | Q2 |
����˵���в���ȷ����
A.�������������仯��Q1��65.6kJ
B.ƽ��������٢��и�������������ͬ
C.����������ƽ��ʱ�����е�CO�����е�H2O(g)�����е�CO2��ת�������
D.������ͬ��������ƽ�������������ټ���0.1molCO��0.4molCO2(g)��ƽ�ⲻ�ƶ�