题目内容
一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇:CO(g)+2H2(g)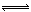 CH3OH(g),根据题意,以下说法正确的是
CH3OH(g),根据题意,以下说法正确的是
 CH3OH(g),根据题意,以下说法正确的是
CH3OH(g),根据题意,以下说法正确的是
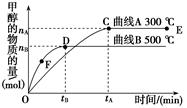
| A.E点的平衡常数大于D点的平衡常数,且该反应的ΔH <0 |
| B.容器中气体的总物质的量E点大于D点 |
| C.当容器内气体密度不变时,说明该反应已达到平衡状态 |
D.v(甲醇)=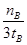 mol/(L·min)-1表示500 ℃以上反应在D点的速率 mol/(L·min)-1表示500 ℃以上反应在D点的速率 |
A
试题分析:A、平衡后300℃时甲醇物质的量大于500℃时甲醇物质的量,所以正反应为放热反应,ΔH <0,E点的平衡常数大于D点的平衡常数,正确;B、该反应的反应前后物质的量为减小趋势,所以生成甲醇越多,总物质的量越小,则D点的总物质的量大于E点,错误;C、根据质量守恒定律,气体的质量不变,而密闭容器的体积恒定,不论反应是否平衡,容器内气体密度不变,所以当容器内气体密度不变时,不能说明该反应已达到平衡状态,错误;D、v(甲醇)=mol/(L·min)-1表示在500℃时,从开始到tB时间内的平均速率,而不是D点的瞬时速率,错误。

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
 N2(g)+3H2(g),在673K、30MPa下,n(NH3)和n(N2)随时间变化的关系如图所示。下列叙述正确的是
N2(g)+3H2(g),在673K、30MPa下,n(NH3)和n(N2)随时间变化的关系如图所示。下列叙述正确的是 

 2HF(g) ΔH>0,且平衡体系的总质量(m总)与总物质的量(n总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是
2HF(g) ΔH>0,且平衡体系的总质量(m总)与总物质的量(n总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是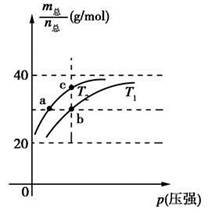
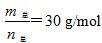 时,n(HF):n[(HF)2]=2:1
时,n(HF):n[(HF)2]=2:1 2Z2在反应过程中的反应速率(υ)与时间(t)的关系曲线,
2Z2在反应过程中的反应速率(υ)与时间(t)的关系曲线,