题目内容
已知(HF)2(g)  2HF(g) ΔH>0,且平衡体系的总质量(m总)与总物质的量(n总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是
2HF(g) ΔH>0,且平衡体系的总质量(m总)与总物质的量(n总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是
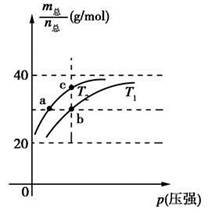
 2HF(g) ΔH>0,且平衡体系的总质量(m总)与总物质的量(n总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是
2HF(g) ΔH>0,且平衡体系的总质量(m总)与总物质的量(n总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是
| A.温度:T1<T2 |
| B.平衡常数:K(a)=K(b)<K(c) |
| C.反应速率:vb>va |
D.当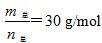 时,n(HF):n[(HF)2]=2:1 时,n(HF):n[(HF)2]=2:1 |
C
本题考查化学平衡移动及其影响因素,意在考查考生对化学平衡移动原理的掌握情况。由题给信息知该反应为气体分子数增大的吸热反应,从图像可以看出,当压强不变时,由T1到T2, 增大,说明n总减小,平衡左移,即平衡向放热反应方向移动,所以由T1到T2为降低温度的过程,即T1>T2,A项错误;由于T1温度较高,升高温度平衡右移,故温度为T1时的平衡常数大于温度为T1时的平衡常数,再结合温度不变平衡常数不变知,K(b)>K(a)=K(c),B项错误;温度越高,反应速率越大,压强越大,反应速率越大,故vb>va,C项正确;设HF为xmol,(HF)2为ymol,当
增大,说明n总减小,平衡左移,即平衡向放热反应方向移动,所以由T1到T2为降低温度的过程,即T1>T2,A项错误;由于T1温度较高,升高温度平衡右移,故温度为T1时的平衡常数大于温度为T1时的平衡常数,再结合温度不变平衡常数不变知,K(b)>K(a)=K(c),B项错误;温度越高,反应速率越大,压强越大,反应速率越大,故vb>va,C项正确;设HF为xmol,(HF)2为ymol,当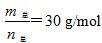 时,有
时,有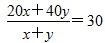 ,解得x=y,即n(HF):n[(HF)2]=1:1,D项错误。
,解得x=y,即n(HF):n[(HF)2]=1:1,D项错误。
 增大,说明n总减小,平衡左移,即平衡向放热反应方向移动,所以由T1到T2为降低温度的过程,即T1>T2,A项错误;由于T1温度较高,升高温度平衡右移,故温度为T1时的平衡常数大于温度为T1时的平衡常数,再结合温度不变平衡常数不变知,K(b)>K(a)=K(c),B项错误;温度越高,反应速率越大,压强越大,反应速率越大,故vb>va,C项正确;设HF为xmol,(HF)2为ymol,当
增大,说明n总减小,平衡左移,即平衡向放热反应方向移动,所以由T1到T2为降低温度的过程,即T1>T2,A项错误;由于T1温度较高,升高温度平衡右移,故温度为T1时的平衡常数大于温度为T1时的平衡常数,再结合温度不变平衡常数不变知,K(b)>K(a)=K(c),B项错误;温度越高,反应速率越大,压强越大,反应速率越大,故vb>va,C项正确;设HF为xmol,(HF)2为ymol,当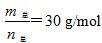 时,有
时,有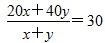 ,解得x=y,即n(HF):n[(HF)2]=1:1,D项错误。
,解得x=y,即n(HF):n[(HF)2]=1:1,D项错误。
练习册系列答案
相关题目
 mol/(L·min)
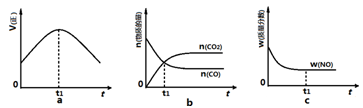
mol/(L·min) 2Z(g);△H<0,达到平衡后,仅改变横坐标条件,下列图像正确的是
2Z(g);△H<0,达到平衡后,仅改变横坐标条件,下列图像正确的是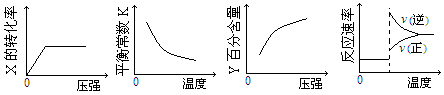
 CH3OH(g),根据题意,以下说法正确的是
CH3OH(g),根据题意,以下说法正确的是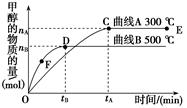
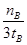 mol/(L·min)-1表示500 ℃以上反应在D点的速率
mol/(L·min)-1表示500 ℃以上反应在D点的速率 2C(g),达平衡后生成1.2mol C,平衡混合气体中C的体积分数为ω。
2C(g),达平衡后生成1.2mol C,平衡混合气体中C的体积分数为ω。 2NH3(g)△H<0平衡时,其他条件不变,升高温度,再次达到平衡时氢气转化率增大
2NH3(g)△H<0平衡时,其他条件不变,升高温度,再次达到平衡时氢气转化率增大 TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应的△S<0
TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应的△S<0
 2CO2(g)+ N2(g)。在密闭容器
2CO2(g)+ N2(g)。在密闭容器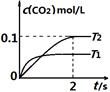
 N2O4(g) △H=-56.9 kJ/mol ②
N2O4(g) △H=-56.9 kJ/mol ②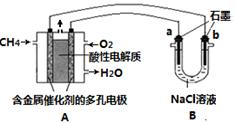

 2Z(g)
2Z(g)