题目内容
下列关于化学反应速率的说法中正确的是( )
| A.决定化学反应速率的主要因素是温度 |
| B.反应速率用于衡量化学反应进行快慢 |
| C.可逆反应达到平衡状态时正逆反应的速率都为0 |
| D.增大反应物的量或提高反应温度一定能增大反应速率 |
B
试题分析:A、决定化学反应速率的主要因素是反应物的性质,错误;B、反应速率用于衡量化学反应进行快慢,这是反应速率的意义,正确;C、可逆反应达到平衡状态时正逆反应的速率相等,但不为0,错误;D、增大反应物的量不一定能增大反应速率,如反应物是固体时,增大反应物的量对反应速率无影响,错误,答案选B。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
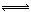 2NH3(g) ?H=—92.4kJ?mol?1
2NH3(g) ?H=—92.4kJ?mol?1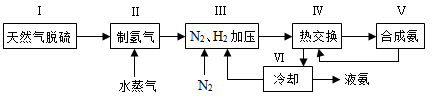
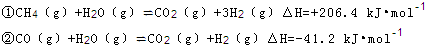
 2C(g),?H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后C的浓度为ω mol/L,放出热量为b kJ。
2C(g),?H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后C的浓度为ω mol/L,放出热量为b kJ。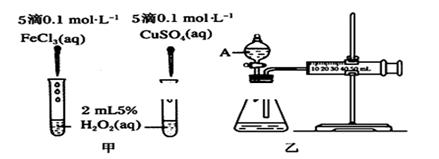

 CH3OH(g),根据题意,以下说法正确的是
CH3OH(g),根据题意,以下说法正确的是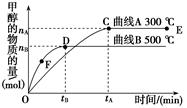
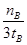 mol/(L·min)-1表示500 ℃以上反应在D点的速率
mol/(L·min)-1表示500 ℃以上反应在D点的速率
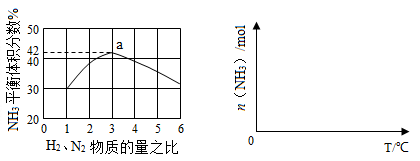
 2Z
2Z 2NH3(g)△H<0平衡时,其他条件不变,升高温度,再次达到平衡时氢气转化率增大
2NH3(g)△H<0平衡时,其他条件不变,升高温度,再次达到平衡时氢气转化率增大 TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应的△S<0
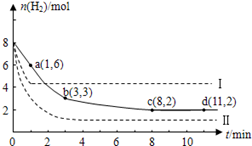
TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应的△S<0 CH3OH(g)+H2O(g)+49kJ。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示。a,b,c,d括号内数据表示坐标.
CH3OH(g)+H2O(g)+49kJ。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示。a,b,c,d括号内数据表示坐标.