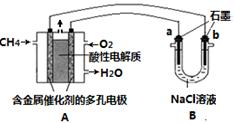
题目内容
(6分) 某研究小组拟用定量的方法测量Al和Fe分别与酸反应的快慢,设计了如下图1所示的装置。
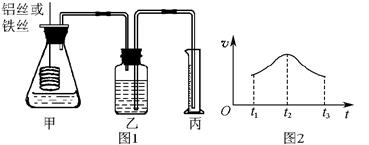
(1)检查图1所示装置气密性的方法是____________________。
(2)若要比较产生气体的快慢,可以测量相同时间段内产生气体的体积,也可以测量__________________________。
(3)实验测得铝丝产生气体的速率(v)与时间(t)的关系如图2所示,则t1~t2时间段内反应速率逐渐加快的主要原因是__________________________________。

(1)检查图1所示装置气密性的方法是____________________。
(2)若要比较产生气体的快慢,可以测量相同时间段内产生气体的体积,也可以测量__________________________。
(3)实验测得铝丝产生气体的速率(v)与时间(t)的关系如图2所示,则t1~t2时间段内反应速率逐渐加快的主要原因是__________________________________。
(9分)(1)用手捂住锥形瓶,观察乙中长导管内液面是否上升 (2)产生相同体积的气体所需时间 (3)反应放热,溶液温度升高 (各2分)
试题分析:(1)根据本题的实验装置选择检查气密性的方法,捂热甲装置之后,若气密性良好,气体膨胀进入乙中,乙中压强增大,会使长导气管中液面上升;(2)要比较产生气体的快慢可以保证时间相等,测气体的体积,也可以保证气体体积相等,测时间;(3)随着时间的进行,氢离子浓度减小,而反应速率加快只能是反应液温度升高,该反应为放热反应。

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
 CO(g)+3H2(g) ΔH>0测得c(CH4)随反应时间(t)的变化如图所示。下列判断正确的是( )
CO(g)+3H2(g) ΔH>0测得c(CH4)随反应时间(t)的变化如图所示。下列判断正确的是( )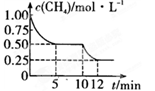
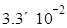 mol/(L·min)
mol/(L·min) bZ(g) △H<0。下图是容器中X、Z的物质的量浓度随时间变化的曲线。
bZ(g) △H<0。下图是容器中X、Z的物质的量浓度随时间变化的曲线。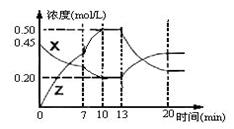
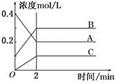
 2B(g)+C(g)
2B(g)+C(g) 2C(g),?H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后C的浓度为ω mol/L,放出热量为b kJ。
2C(g),?H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后C的浓度为ω mol/L,放出热量为b kJ。 2Z(g);△H<0,达到平衡后,仅改变横坐标条件,下列图像正确的是
2Z(g);△H<0,达到平衡后,仅改变横坐标条件,下列图像正确的是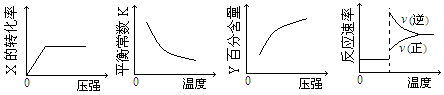
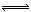 CH3OH(g),根据题意,以下说法正确的是
CH3OH(g),根据题意,以下说法正确的是
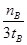 mol/(L·min)-1表示500 ℃以上反应在D点的速率
mol/(L·min)-1表示500 ℃以上反应在D点的速率 2CO2(g)+ N2(g)。在密闭容器
2CO2(g)+ N2(g)。在密闭容器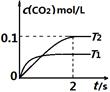
 N2O4(g) △H=-56.9 kJ/mol ②
N2O4(g) △H=-56.9 kJ/mol ②