题目内容
【题目】工业上用铝土矿(主要成分是Al2O3、Fe2O3、SiO2)提纯Al2O3做冶炼铝的原料,提取的操作过程可用以下流程图表示:
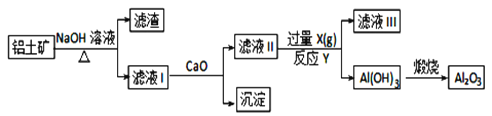
已知:Na2SiO3 + Ca(OH)2= CaSiO3↓+ 2NaOH
(1)氢氧化钠溶液浸取铝土矿时,发生反应的离子方程式有:______________________、______________________。
(2)滤液II中通入过量的气体X是________。反应的化学方程式:____________________。
【答案】SiO2+2OH-=SiO32-+H2O Al2O3+ 2OH- = 2AlO2-+ H2O CO2 NaAlO2+ CO2+ 2H2O=Al(OH)3↓+NaHCO3
【解析】
Fe2O3和氢氧化钠不反应,而氧化铝、二氧化硅能反应,步骤I利用过滤除去Fe2O3,滤渣为氧化铁,滤液I含有偏铝酸钠、硅酸钠,加入氧化钙,硅酸钠与氢氧化钙反应生成硅酸钙沉淀,过滤后,滤液II中含有偏铝酸钠,通入过量的二氧化碳,生成氢氧化铝沉淀和碳酸氢钠,滤液Ⅲ中溶质是碳酸氢钠,加热分解氢氧化铝得到氧化铝。
根据以上分析,(1)氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,二氧化硅与氢氧化钠溶液反应生成硅酸钠和水,反应的离子方程式分别是:Al2O3 + 2OH- = 2AlO2-+ H2O、SiO2+2OH-=SiO32-+H2O;
(2)滤液II中含有偏铝酸钠,偏铝酸钠能与过量二氧化碳气体反应生成氢氧化铝沉淀和碳酸氢钠,所以步骤②是通入过量的气体X是CO2,反应的化学方程式是:NaAlO2+ CO2+ 2H2O=Al(OH)3↓+ NaHCO。

 计算高手系列答案
计算高手系列答案【题目】在下右图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶。则a和b不满足题目要求的是
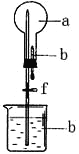
选项 | a(干燥气体) | b(液体) |
A | Cl2 | 饱和NaOH溶液 |
B | SO2 | 4mol/LNaOH溶液 |
C | NO2 | 水 |
D | NH3 | 1mol/L盐酸 |
A. A B. B C. C D. D