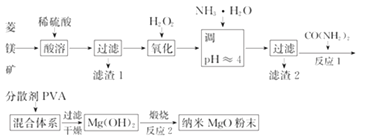
题目内容
【题目】以铝土矿为原料,提取氧化铝,冶炼铝的工艺流程如下,下列说法错误的是
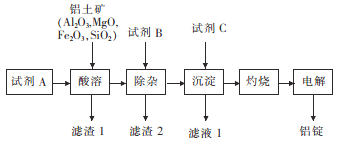
已知:滤渣2主要成分是氢氧化铁、氢氧化镁,B的焰色呈黄色。
A. 试剂A可以是稀硫酸或盐酸 B. 加入试剂B除去Mg2+、Fe3+
C. 滤渣1主要成分是SiO2 D. 电解氧化铝时在阴极上定期补炭块
【答案】D
【解析】A、滤渣2成分是氢氧化铁、氢氧化镁,因此滤渣1的成分是SiO2,SiO2属于酸性氧化物,不溶于硫酸和盐酸,因此试剂A为稀硫酸或盐酸,故A说法正确;B、根据题目信息,滤渣2的成分是氢氧化铁、氢氧化镁,因此试剂B为NaOH,作用是除去杂质Mg2+和Fe3+,故B说法正确;C、根据A选项的分析,故C说法正确;D、电解熔融状态的氧化铝,得到铝单质和氧气,炭不参与反应,因此不需要补充,故D说法错误。

 走进文言文系列答案
走进文言文系列答案【题目】【2017届江苏省海安高级中学高三月考】一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
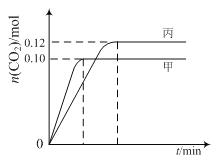
各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示:
容器 | 温度/℃ | 起始物质的量/mol | |
NO (g) | CO (g) | ||
甲 | T1 | 0.20 | 0.20 |
乙 | T1 | 0.30 | 0.30 |
丙 | T2 | 0.20 | 0.20 |
下列说法正确的是
A.该反应的正反应为吸热反应
B.达到平衡时,乙中CO2的体积分数比甲中的小
C.T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2,则反应达到新平衡前v(正)>v(逆)
D.T2℃时,若起始时向丙中充入0.06mol N2和0.12 mol CO2,则达平衡时N2的转化率大于40%
【题目】现有部分元素的性质与原子(或分子)结构如下表所示:
元素编号 | 元素性质与原子(或分子)结构 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质分子为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第三周期元素的金属离子中半径最小 |
U | 第三周期元素的非金属离子还原性最弱 |
(1)写出元素T含有10个中子的原子符号:_________________。写出X与Y形成的化合物的电子式______________。
(2)Y与Z相比,金属性较强的是________(填元素符号),下列表能证明这一事实的是__________(填字母)。
a.Y单质的熔点比Z单质低 b.Y单质与水反应比Z单质与水反应剧烈
c.Y的化合价比Z低 d.Y最高价氧化物对应的水化物的碱性比Z的强
(3)写出Z与U最高价氧化物对应的水合物相互反应的方程式____________________________
(4)M物质由T、Y、Z三种元素组成,请写出含0.1 mol的M溶液与60mL5 mol·L-1
的盐酸反应的离子反应式________________________________
(5)元素X与氢元素以原子个数比1∶2化合形成常用于火箭燃料的化合物元素T和氢元素以原子个数比为1∶1化合形成化合物Q,Q与W发生氧化还原反应,反应的产物不污染环境,写出该反应的化学方程式:__________________________________。