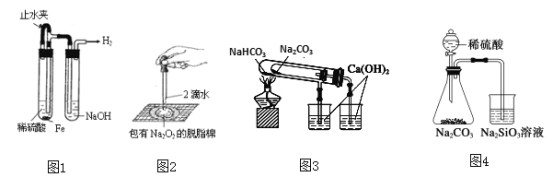
题目内容
【题目】将12.8g铜片加入到100ml一定浓度的硝酸溶液中,铜片完全溶解,产生NO和NO2的混合气体4.48L(标准状况下);若向反应后的溶液中加入400ml、2mol/L NaOH溶液,能使溶液中的Cu2+恰好完全沉淀。下列说法不正确的是
A. 反应后溶液中剩余NO3-的物质的量为0.4mol
B. 原硝酸溶液的物质的量浓度为10mol/L
C. 铜片与硝酸反应过程中转移电子0.4mol
D. 混合气体中NO和NO2的体积之比为1︰1
【答案】A
【解析】
A、反应后溶液中,溶质是NaNO3,根据元素守恒计算反应后溶液中剩余NO3-的物质的量;
B、根据氮元素守恒计算原硝酸溶液的物质的量浓度;
C、根据铜的物质的量计算转移电子的物质的量;
D、根据电子守恒、元素守恒计算NO和NO2的体积比;
A、向反应后的溶液中加入NaOH溶液,反应后溶液中的溶质是NaNO3,根据元素守恒![]() 0.4L
0.4L![]() 2mol/L=0.8mol,故A错误;
2mol/L=0.8mol,故A错误;
B、根据氮元素守恒,原硝酸溶液的物质的量=反应后溶液中NO3-的物质的量+产生NO和NO2的物质的量=0.8mol+![]() =1mol,原硝酸溶液的物质的量浓度为
=1mol,原硝酸溶液的物质的量浓度为![]() 10mol/L,故B正确;
10mol/L,故B正确;
C、反应中转移电子的物质的量=![]() 0.4mol,故C正确;
0.4mol,故C正确;
D、NO和NO2的物质的量分别是xmol、ymol,根据元素守![]() ①,根据得失电子守恒
①,根据得失电子守恒![]() ②;联立①②,解方程组的x=0.1、y=0.1,所以混合气体中NO和NO2的体积之比为1︰1,故D正确。
②;联立①②,解方程组的x=0.1、y=0.1,所以混合气体中NO和NO2的体积之比为1︰1,故D正确。

【题目】甲、乙、丙、丁均为中学化学常见的纯净物,它们之间有如图所示的反应关系。下列物质组不满足上述转化关系的是( )
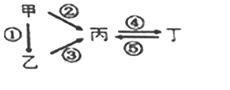
选项 | 甲 | 乙 | 丙 | 丁 |
A | N2 | NH3 | NO | NO2 |
B | Si | SiO2 | Na2SiO3 | Na2CO3 |
C | S | H2S | SO3 | H2SO4 |
D | Al | Al2O3 | NaAlO2 | Al(OH)3 |
A. AB. BC. CD. D