题目内容
16.HgS为何能溶于Na2S和NaOH的混合溶液,而不溶于(NH4)2S和NH3•H2O中?分析 当硫离子浓度较高时,HgS与硫离子能形成[HgS2]2-配离子,据此解答即可.
解答 解:因为在Na2S和NaOH的混合溶液中,溶液为强碱性,S2-水解程度小,即硫离子浓度较大,硫离子能与HgS生成了[HgS2]2-配离子,而使HgS溶解,而在(NH4)2S和NH3•H2O的混合溶液中S2-离子水解程度较大,硫离子浓度低不能生成[HgS2]2-,所以HgS不溶,
故答案为:HgS在Na2S和NaOH的混合溶液中形成配合物,促进了HgS的溶解,而在(NH4)2S和NH3•H2O中不能形成配合物.
点评 本题主要考查的是难溶电解质的溶解平衡与配合物的知识,利用弱根离子的水解是解决本题的关键,难度稍大.

练习册系列答案
相关题目
6.如果a g某气体中含有的分子数为b,则该气体在标准状况下的摩尔质量为( )
| A. | $\frac{a}{b{N}_{A}}$ | B. | $\frac{b}{a}$NA | C. | $\frac{a}{b}$ NA | D. | $\frac{b}{a{N}_{A}}$ |
7.下列与氯气的氧化性无关的是( )
| A. | 氯气被碱液吸收 | B. | 金属钠在氯气中燃烧 | ||
| C. | 氯气变为液氯 | D. | 氯气溶于水 |
1.下列叙述正确的是( )
| A. | 任何晶体中,若含有阳离子也一定含有阴离子 | |
| B. | 原子晶体中只含有共价键 | |
| C. | 离子晶体中只含有离子键 | |
| D. | 分子晶体中只存在分子间作用力,不含化学键 |
8.下列用电子式表示的形成过程正确的是( )
| A. | 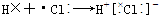 | B. | 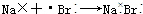 | ||
| C. | 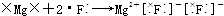 | D. |  |
6.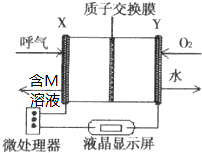 查处酒后驾驶所采用的“便携式乙醇测量仪”,以燃料电池为工作原理,如图,两电极材料均为Pt.理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为M,其中一个电极的反应式为:CH3CH2OH-2e-→M+2H+.下列说法中正确的是( )
查处酒后驾驶所采用的“便携式乙醇测量仪”,以燃料电池为工作原理,如图,两电极材料均为Pt.理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为M,其中一个电极的反应式为:CH3CH2OH-2e-→M+2H+.下列说法中正确的是( )
 查处酒后驾驶所采用的“便携式乙醇测量仪”,以燃料电池为工作原理,如图,两电极材料均为Pt.理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为M,其中一个电极的反应式为:CH3CH2OH-2e-→M+2H+.下列说法中正确的是( )
查处酒后驾驶所采用的“便携式乙醇测量仪”,以燃料电池为工作原理,如图,两电极材料均为Pt.理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为M,其中一个电极的反应式为:CH3CH2OH-2e-→M+2H+.下列说法中正确的是( )| A. | 电池内部H+向X极移动 | |
| B. | 另一极Y极的电极反应式为:O2+4e-+2H2O=4OH- | |
| C. | 乙醇在X极上发生还原反应,电子经过外电路流向Y极 | |
| D. | 电池总反应为:2CH3CH2OH+O2→2CH3CHO+2H2O |
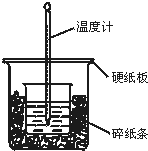 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
 和双酚A:
和双酚A: 缩聚而成,其反应方程式为
缩聚而成,其反应方程式为 .
.