题目内容
11.有关化学反应方向的判断,下列说法中正确的是( )| A. | 放热反应均是自发反应 | |
| B. | 物质的量增加的反应,△S为正值 | |
| C. | 如果△H和△S均为正值,当温度升高时,反应可能自发进行 | |
| D. | △S为正值的反应均是自发反应 |
分析 反应能否自发进行,取决于焓变与熵变的综合判据,当△H-T•△S<0时,反应可自发进行,否则不能,以此解答.
解答 解:A、放热反应有利于反应的自发进行,但是有的放热反应在常温下不能自发进行,反应能否自发进行的判据:△H-T△S<0,反应一定能自发进行,故A错误;
B、只有气体的物质的量增加的反应,△S为正值,故B错误;
C、如果△H和△S均为正值,当温度升高时,可满足△H-T•△S<0时,反应可自发进行,故C正确.
D、△S为正值的反应不一定是自发反应,如水的分解,故D错误;
故选C;
点评 本题考查反应热与焓变,题目难度不大,注意把握化学反应进行的方向取决于焓变和熵变的综合判据,不能只根据一种物理量进行判断.

练习册系列答案
相关题目
13.2001年11月,美军向躲藏在山洞中的阿富汗恐怖分子使用了一种名为BLU-82的燃料炸弹,这种炸弹爆炸能耗尽山洞中的氧气,使洞中的生物窒息死亡.该炸弹的主装药是环氧乙烷(化学式为C2H4O).关于环氧乙烷的下列说法正确的是( )
| A. | 它是氧化物 | B. | 它含有3种元素 | ||
| C. | 它的摩尔质量是44g | D. | 1 mol环氧乙烷含有2NA个碳原子 |
19.已知:①H2O(g)═H2O(l)△H=-Q1 kJ/mol
②C2H5OH(g)═C2H5OH(l)△H=-Q2 kJ/mol
③C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H=-Q3 kJ/mol
下列判断正确的是( )
②C2H5OH(g)═C2H5OH(l)△H=-Q2 kJ/mol
③C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H=-Q3 kJ/mol
下列判断正确的是( )
| A. | 酒精的燃烧热为Q3 kJ | |
| B. | 若使46 g酒精液体完全燃烧,最后恢复到室温,释放出的热量为(3Q1-Q2+Q3)kJ | |
| C. | H2O(g)→H2O(l)释放出了热量,所以该过程为化学变化 | |
| D. | 从反应③可知1mol C2H5OH(g)能量高于2 mol CO2(g)和3 mol H2O(g)的总能量 |
3.下列物质长期放在空气中质量不增加的是( )
| A. | 氢氧化钠固体 | B. | 浓硫酸 | C. | 浓盐酸 | D. | 生石灰 |
20.下列各组中,不管以何种比例混合,只要总质量一定,充分燃烧后生成的二氧化碳的量不变的是( )
| A. | 乙炔(C2H2)和甲苯 | B. | 乙醇和丙醇(CH3CH2CH2OH) | ||
| C. | 乙醇和乙醚(C2H5OC2H5) | D. | 甲醛( HCHO)和乙酸 |
1.基态原子的核外电子排布的原则不包括( )
| A. | 能量最低原则 | B. | 能量守恒原理 | C. | 泡利不相容原理 | D. | 洪特规则 |
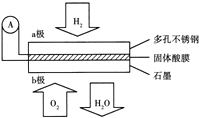 已知在25℃、1.013×105Pa下,1mol氢气完全燃烧生成液态水放出285kJ的热量,请回答下列问题:
已知在25℃、1.013×105Pa下,1mol氢气完全燃烧生成液态水放出285kJ的热量,请回答下列问题: