题目内容
2. 已知在25℃、1.013×105Pa下,1mol氢气完全燃烧生成液态水放出285kJ的热量,请回答下列问题:
已知在25℃、1.013×105Pa下,1mol氢气完全燃烧生成液态水放出285kJ的热量,请回答下列问题:(1)生成物能量总和小于(填“大于”、“小于”或“等于”)反应物能量总和.
(2)若2mol氢气完全燃烧生成水蒸气,则放出的热量<570kJ(填“>”、“<”或“=”).
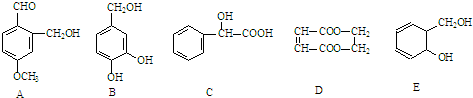
(3)某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2═2H2O,则其工作时b极电极反应式为O2+4e-+4H+=2H2O,在电池内部H+的流动方向为:由a极经固体酸膜流向b极.
分析 (1)反应热与反应物和生成物总能量有关,反应物总能量大于生成物总能量,反应放热,反之吸热;
(2)物质的聚集状态不同,反应热不同,气态物质变为液态物质放热,反之吸热;
(3)根据电池总反应:2H2+O2=2H2O可知:通入氢气的一极为电池的负极,发生氧化反应,反应为H2-2e-═2H+,通入氧气的一极为电池的正极,发生还原反应,反应为O2+4e-+4H+=2H2O;电池工作时,电子通过外电路从负极流向正极,即从a极流向b极,电解质溶液中阳离子向正极移动,即H+由a极通过固体酸电解质传递到b极;
解答 解:(1)反应放热,则生成物的总能量小于反应物的总能量,故答案为:小于;
(2)2mol氢气完全燃烧生成液态水放出570kJ的热量,但液态水变为气态水要吸热,若2mol氢气完全燃烧生成水蒸气,则放出的热量小于570kJ,故故答案为:<;
(3)该电池为酸性电池,通入氧气的b极为电池的正极,发生还原反应,b极上的电极反应式为:O2+4e-+4H+=2H2O; 原电池中,a极氢气失电子生成H+,阳离子向正极移动,所以H+由a极通过固体酸电解质传递到b极,故答案为:O2+4e-+4H+=2H2O;a;b.
点评 本题考查较为综合,涉及化学反应能量的计算,原电池的工作原理以及电极反应式的书写,题目难度中等,注意把握原电池电极反应式的书写方法.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.有关化学反应方向的判断,下列说法中正确的是( )
| A. | 放热反应均是自发反应 | |
| B. | 物质的量增加的反应,△S为正值 | |
| C. | 如果△H和△S均为正值,当温度升高时,反应可能自发进行 | |
| D. | △S为正值的反应均是自发反应 |
12.用NA表示阿伏加德罗常数,下列叙述不正确的是( )
| A. | CO2和O2组成的混合物中共有NA个分子,其中氧原子数为2NA | |
| B. | 78g过氧化钠与足量的CO2和H2O(g)混合气体充分反应,转移的电子数一定为NA | |
| C. | 1 mol 氢氧根和1 mol 羟基中含有的质子数均为 9 NA | |
| D. | 标准状况下,2.24L氯仿(CHCl3)中含有C-Cl数目为0.3NA |
 (加聚反应)
(加聚反应) (取代反应)
(取代反应) (取代反应)
(取代反应) ;若
;若 若在上述类似条件下发生反应,请写出反应的方程式
若在上述类似条件下发生反应,请写出反应的方程式 .
. .为了防止发生事故,使用前要先检验氯仿是否变质,写出检验所用的试剂硝酸银溶液.
.为了防止发生事故,使用前要先检验氯仿是否变质,写出检验所用的试剂硝酸银溶液. .
.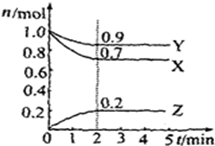 某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示.由图中数据分析:
某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示.由图中数据分析: