题目内容
16.根据元素周期表回答下列问题:(填写元素符号或化学式)(1)非金属性最强的元素是F,在反应中易得(填“得”或“失”)电子;
(2)第3周期中,原子半径最大的元素(稀有气体元素除外)是Na,非金属性最强的元素是Cl;其最高价氧化物对应水化物酸性最强的是HClO4.
(3)ⅤA族中,原子半径最小的元素是N,其气态氢化物为NH3.
(4)C、Si、S三种元素中,适合做半导体材料的是Si.
分析 (1)元素周期表中非金属性最强的元素是F,最外层7个电子,容易得到1个电子达到8个电子的稳定结构;
(2)同一周期,原子序数越大,半径越小;原子序数越大,元素的非金属性越强,其对应最高价氧化物的水合物的酸性越强(0族除外);
(3)同一主族,原子序数越小,半径越小,依据最低负价判断氢化物的化学式;
(4)在金属与非金属分界线附近的元素适合作半导体材料.
解答 解:(1)元素周期表中非金属性最强的元素是F,最外层7个电子,容易得到1个电子达到8个电子的稳定结构,故答案为:F;得;
(2)钠元素的原子序数最小,半径最大,Cl的原子序数最大,非金属性最强,其最高价氧化物的水合物为高氯酸,故答案为:Na;Cl;HClO4;
(3)VA族中的原子序数最小,故半径最小,由于N的最低负价我-3,故氢化物为NH3,故答案为:N;NH3;
(4)Si处于金属与非金属交界处,能作半导体材料,故答案为:Si.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,涉及元素非金属性比较、氢化物化学式书写等,难度中等.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
18.宋代著名法医学家宋慈 的《洗冤集录》中有-银针验毒的记载,“银针验毒”的原理是 4Ag+2H2S+O2═2X+2H2O,下列说法不正确的是( )
| A. | X的化学式为Ag2S | B. | 银针验毒时,空气中氧气得到电子 | ||
| C. | 反应中Ag和H2S均是还原剂 | D. | 每生成1mo1X,反应转移2mo1 e- |
11.有关化学反应方向的判断,下列说法中正确的是( )
| A. | 放热反应均是自发反应 | |
| B. | 物质的量增加的反应,△S为正值 | |
| C. | 如果△H和△S均为正值,当温度升高时,反应可能自发进行 | |
| D. | △S为正值的反应均是自发反应 |
5.物质发生化学变化时,反应前后肯定不发生变化的是:( )
①元素种类 ②原子总数 ③分子总数 ④物质的种类 ⑤物质的总质量 ⑥物质的总能量.
①元素种类 ②原子总数 ③分子总数 ④物质的种类 ⑤物质的总质量 ⑥物质的总能量.
| A. | ①②③⑤ | B. | ①②⑤ | C. | ②⑤⑥ | D. | ①④⑤⑥ |
6.某元素M2+核外电子数为10,该元素是下列原子中的( )
| A. | Cr | B. | Mg | C. | Fe | D. | Ti |
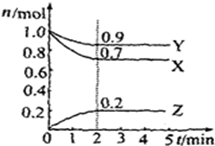 某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示.由图中数据分析:
某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示.由图中数据分析:
 (写结构简式).
(写结构简式). 在一定条件下可水解为
在一定条件下可水解为 和R1-NH2,则F在强酸和长时间加热条件下发生水解反应的化学方程式是
和R1-NH2,则F在强酸和长时间加热条件下发生水解反应的化学方程式是 .
.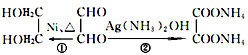 转化的反应方程式.
转化的反应方程式.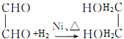 、②
、② .
.