题目内容
19.已知:①H2O(g)═H2O(l)△H=-Q1 kJ/mol②C2H5OH(g)═C2H5OH(l)△H=-Q2 kJ/mol
③C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H=-Q3 kJ/mol
下列判断正确的是( )
| A. | 酒精的燃烧热为Q3 kJ | |
| B. | 若使46 g酒精液体完全燃烧,最后恢复到室温,释放出的热量为(3Q1-Q2+Q3)kJ | |
| C. | H2O(g)→H2O(l)释放出了热量,所以该过程为化学变化 | |
| D. | 从反应③可知1mol C2H5OH(g)能量高于2 mol CO2(g)和3 mol H2O(g)的总能量 |
分析 A、燃烧热指的是在25℃101KP时,1mol可燃物完全燃烧生成稳定的氧化物时放出的热量,单位为KJ/mol;
B、B、依据盖斯定律结合热化学方程式计算得到;
C、气态水变化为液态水是物质状态变化,无新物质生成;
D、依据反应前后能量守恒分析判断.
解答 解:A、C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g);△H=-Q3kJ/mol.反应中生成的水是气体,不是稳定氧化物,故燃烧热不是Q3kJ,故A错误;
B、依据热化学方程式:①H2O(g)═H2O(l)△H=-Q1 kJ/mol;
②C2H5OH(g)═C2H5OH(l)△H=-Q2kJ/mol;
③C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H=-Q3kJ/mol.
结合盖斯定律计算,③-②+①×3,得到C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l);△H=-(3Q1-Q2+Q3)kJ/mol,
23 g液体酒精物质的量为0.5mol,反应放热为:(1.5Q1-0.5Q2+0.5Q3)kJ,故B正确;
C、气态水变化为液态水是物质状态变化,无新物质生成,故C错误;
D、③C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H=-Q3kJ/mol.反应是放热反应,1mol C2H5OH(g)和3molO2的总能量高于2CO2(g)和3H2O(g)的总能量,故D错误;
故选B.
点评 本题考查了反应热量变化的分析判断,燃烧热的概念应用,盖斯定律的计算应用,反应过程中能量守恒的应用,题目较简单.

练习册系列答案
相关题目
1.下列叙述正确的是( )
| A. | 硫酸钡难溶于水,故硫酸钡为弱电解质 | |
| B. | 石墨虽能导电,但不是电解质,而是非电解质 | |
| C. | 反应热只与反应体系的始态和终态有关,而与反应的途径无关 | |
| D. | 所有的放热反应都能在常温常压下自发进行 |
11.有关化学反应方向的判断,下列说法中正确的是( )
| A. | 放热反应均是自发反应 | |
| B. | 物质的量增加的反应,△S为正值 | |
| C. | 如果△H和△S均为正值,当温度升高时,反应可能自发进行 | |
| D. | △S为正值的反应均是自发反应 |
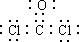 .为了防止发生事故,使用前要先检验氯仿是否变质,写出检验所用的试剂硝酸银溶液.
.为了防止发生事故,使用前要先检验氯仿是否变质,写出检验所用的试剂硝酸银溶液.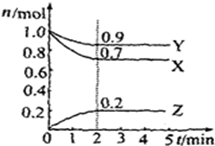 某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示.由图中数据分析:
某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示.由图中数据分析:

 (写结构简式).
(写结构简式). 在一定条件下可水解为
在一定条件下可水解为 和R1-NH2,则F在强酸和长时间加热条件下发生水解反应的化学方程式是
和R1-NH2,则F在强酸和长时间加热条件下发生水解反应的化学方程式是 .
. 、③金刚石、④氨水、⑤CH3CH2CH2CH3、⑥${\;}_{17}^{37}$Cl、⑦${\;}_{17}^{35}$Cl、⑧C70、⑨氨气.
、③金刚石、④氨水、⑤CH3CH2CH2CH3、⑥${\;}_{17}^{37}$Cl、⑦${\;}_{17}^{35}$Cl、⑧C70、⑨氨气.