题目内容
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
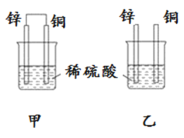
(1)下列说法正确的是____________。
A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少 D.甲乙两烧杯中溶液的 pH 均增大
(2)同条件下两烧杯中产生同体积的气体,需要的时间甲________乙(填“>”“<”或“=”)。
(3)请写出甲乙图中构成原电池的负极电极反应式:__________________。
(4)当甲中溶液质量增重15.75g时,电极上转移电子数目为______________。
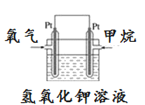
(5)如图为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是KOH。写出正极的电极反应方程式为_________。
【答案】BD < Zn-2e-=Zn2+ 0.5NA O2+ 2H2O+4e= 4OH
【解析】
甲装置是原电池,锌是负极,铜是正极,乙不是原电池,直接发生化学反应,在甲烷氧气燃料电池中,通入甲烷的是负极,发生氧化反应,通入氧气的为正极,发生还原反应,书写电极反应式时需考虑电解质的后续反应。
(1)A.甲是化学能转变为电能的装置,乙不是,故A错误;
B.乙装置中铜片不反应,也没构成原电池的正极,所以铜片上没有明显变化,故B正确;
C.甲、乙中锌片质量都减少,铜片质量都不变,故C错误;
D.两个烧杯中都产生氢气,氢离子浓度都降低,所以溶液的pH均增大,故D正确;
故选BD;
(2)甲中形成原电池,加快Zn与稀硫酸的反应,即两烧杯中产生气泡的速度:甲>乙,两烧杯中产生同体积的气体,需要的时间甲小于乙,故答案为:<;
(3)构成原电池的负极是锌失电子发生氧化反应,电极反应式为:Zn-2e-=Zn2+,故答案为:Zn-2e-=Zn2+;
(4)根据以下关系式:

x=![]() =0.5NA,即当甲中溶液质量增重15.75g时,电极上转移电子数目为0.5NA,故答案为:0.5NA;
=0.5NA,即当甲中溶液质量增重15.75g时,电极上转移电子数目为0.5NA,故答案为:0.5NA;
(5)甲烷氧气燃料电池中,通入氧气的为正极,发生还原反应,电极反应式为:O2+ 2H2O+4e= 4OH,故答案为:O2+ 2H2O+4e= 4OH。

【题目】已知:2H2(g)+O2(g)=2H2O(g)反应放出的热量为483.6 kJ。有关键能数据如表所示:则水分子中O—H键键能为( )
化学键 | H-H | O=O |
键能/(kJ·mol-1) | 436 | 498 |
A.463.4 kJ·mol-1B.926.8 kJ·mol-1C.221.6 kJ·mol-1D.413 kJ·mol-1