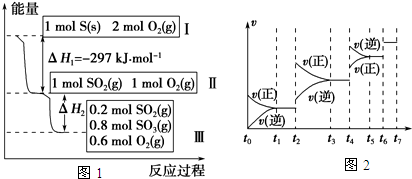
题目内容
已知: 2SO2(g)+O2(g) 2SO3(g) ΔH=-196.0kJ·mol-1
2SO3(g) ΔH=-196.0kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=-113.0
kJ·mol-1
2NO2(g) ΔH=-113.0
kJ·mol-1
2SO3(l) 2SO3(g)
ΔH= 20.0 kJ·mol-1
2SO3(g)
ΔH= 20.0 kJ·mol-1
则NO2与SO2反应生成SO3(l)和一种无色气体的热化学方程式 ;
若在一定条件下,将NO2与SO2以体积比1:2置于恒容密闭容器中发生上述反应,
①下列能说明反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 molNO2
②该反应达平衡时,测得NO2的转化率为50%,则反应前后容器内压强比为 。
③恒压密闭容器中发生上述反应时,若加入Ar气,使得反应速率 (变大、变小或不变)。
SO2(g)+NO2(g) SO3(l)+NO(g)
△H=-51.5 kJ·mol-1
SO3(l)+NO(g)
△H=-51.5 kJ·mol-1
①a,b ② 6:5 ③变小
【解析】考查盖斯定律的应用。由反应①2SO2(g)+O2(g) 2SO3(g)
ΔH=-196.0kJ·mol-1、反应②2NO(g)+O2(g)
2SO3(g)
ΔH=-196.0kJ·mol-1、反应②2NO(g)+O2(g) 2NO2(g)
ΔH=-113.0 kJ·mol-1和③2SO3(l)
2NO2(g)
ΔH=-113.0 kJ·mol-1和③2SO3(l) 2SO3(g)
ΔH= 20.0 kJ·mol-1可知,即①-②-③得2SO2(g)+2NO2(g)
2SO3(g)
ΔH= 20.0 kJ·mol-1可知,即①-②-③得2SO2(g)+2NO2(g) 2SO3(l)+2NO(g),所以其△H=-103
kJ·mol-1。
2SO3(l)+2NO(g),所以其△H=-103
kJ·mol-1。
①因为反应前后体积是变化的,所以当压强不再变化时,可以说明已经达到平衡。颜色的深浅与其浓度大小有关,所以当颜色不再变化时,也可以说明已经达到平衡状态。三氧化硫是液体,C不正确。消耗消耗1 mol SO3的同时必然生成1 molNO2 m,不能说明。
②
SO2(g)+NO2(g) SO3(l)+NO(g)
SO3(l)+NO(g)
起始量(mol) 2 1 0 0
转化量(mol) 0.5 0.5 0.5 0.5
平衡量(mol) 1.5 0.5 0.5 0.5
反应前后容器内压强比为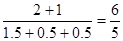 .
.
③恒压密闭容器中发生上述反应时,若加入Ar气,则容器的体积必然增大,即物质的浓度会减小,反应速率则降低。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| 容器 | SO2(mol) | O2(mol) | 氦气(mol) | 达平衡时实际热效应(kJ?mol-1) |
| 甲 | 2 | 1 | 0 | △Hl |
| 乙 | 1 | 0.5 | 0 | △H2 |
| 丙 | 1 | 0.5 | 1 | △H3 |
| A、△Hl=-197 kJ?mol-1 |
| B、△H2=△H3 |
| C、△Hl=2△H2 |
| D、△Hl>△H3 |
 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义. 硫酸生产主要有硫磺法和硫铁矿法等,这两种制法均经过催化氧化步骤.
硫酸生产主要有硫磺法和硫铁矿法等,这两种制法均经过催化氧化步骤. 2SO3(g),△H=-197kJ/mol.实验测得某条件下4molSO2发生上述反应时放出275.8kJ热量,则SO2的转化率(即消耗的SO2占原来SO2的百分比)为
2SO3(g),△H=-197kJ/mol.实验测得某条件下4molSO2发生上述反应时放出275.8kJ热量,则SO2的转化率(即消耗的SO2占原来SO2的百分比)为