题目内容
2013年,央视《经济半小时》曝光了部分药企用工业硫磺熏制山银花以及没有功效的山银花杂质入药,其中包括广药集团旗下药厂生产的维C银翘片.维C银翘片被曝光“涉硫”后,给中药制药企业敲响了警钟.在恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示.(已知:2SO2(g)+O2(g)?2SO3(g),△H=-196.6KJ/mol)
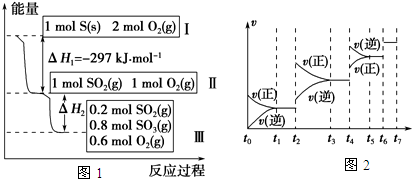
请回答下列问题:
(1)写出能表示固体硫的燃烧热的热化学方程式: .
(2)恒温恒容时,lmol SO2和2mol O2充分反应,放出热量的数值比|△H2| (填“大”、“小”或“相等”)
(3)将Ⅲ中的混合气体通入足量的NaOH溶液中消耗NaOH的物质的量为 ,若溶液中发生了氧化还原反应,则该过程的离子方程式为 .
(4)某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中SO3的百分含量最高的一段时间是 .
(5)各阶段平衡时对应的平衡常数如下表所示:
K1、K2、K3、K4之间的关系为 .

请回答下列问题:
(1)写出能表示固体硫的燃烧热的热化学方程式:
(2)恒温恒容时,lmol SO2和2mol O2充分反应,放出热量的数值比|△H2|
(3)将Ⅲ中的混合气体通入足量的NaOH溶液中消耗NaOH的物质的量为
(4)某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是
(5)各阶段平衡时对应的平衡常数如下表所示:
| t1-t2 | t3-t4 | t5-t6 | t6-t7 |
| K1 | K2 | K3 | K4 |
分析:(1)燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量;
(2)恒温恒容时,开始为1molSO2和2molO2 与开始为1molSO2和1molO2 相比,开始为1molSO2和2molO2 的SO2转化率高;
(3)反应最后得到硫酸钠,根据钠原子、硫原子原子守恒计算;
(4)t2~t3段正逆速率都加快,且v(正)>v(逆),平衡正向移动,t4~t5段正逆速率都加快,且v(正)<v(逆),平衡逆向移动,该反应为体积减小的放热反应,若升高温度,平衡逆向移动,若增大压强,平衡正向移动,故t2~t3段为增大压强,t4~t5段为升高温度;
t2~t3段为增大压强后,平衡正向移动,SO3的含量升高,至t3~t4平衡时含量达最高;
(5)根据K只与温度有关,温度增大,K减小;
(2)恒温恒容时,开始为1molSO2和2molO2 与开始为1molSO2和1molO2 相比,开始为1molSO2和2molO2 的SO2转化率高;
(3)反应最后得到硫酸钠,根据钠原子、硫原子原子守恒计算;
(4)t2~t3段正逆速率都加快,且v(正)>v(逆),平衡正向移动,t4~t5段正逆速率都加快,且v(正)<v(逆),平衡逆向移动,该反应为体积减小的放热反应,若升高温度,平衡逆向移动,若增大压强,平衡正向移动,故t2~t3段为增大压强,t4~t5段为升高温度;
t2~t3段为增大压强后,平衡正向移动,SO3的含量升高,至t3~t4平衡时含量达最高;
(5)根据K只与温度有关,温度增大,K减小;
解答:解:(1)燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量,所以,硫的物质的量为1mol.由图1可知1molS(s)完全燃烧放出的热量为297KJ,所以,硫的燃烧热的热化学方程式S(s)+O2(g)═SO2(g)△H=-297 KJ?mol-1;
故答案为:S(s)+O2(g)═SO2(g)△H=-297 KJ?mol-1;
(2)恒温恒容时,开始为1molSO2和2molO2 与开始为1molSO2和1molO2 相比,增大氧气的浓度,平衡正向移动,所以开始为1molSO2和2molO2 的SO2转化率高,放出热量的数值比|△H2|大;
故答案为:大;
(3)反应最后得到硫酸钠,根据钠原子、硫原子原子守恒,n(NaOH)=2n(S)=2×(0.2+0.8)mol=2mol.
若发生氧化还原反应,则是SO2被O2氧化,离子方程式为2SO2+O2+4OH-═2SO42-+2H2O.
故答案为:2mol;2SO2+O2+4OH-═2SO42-+2H2O;
(4)t2~t3段正逆速率都加快,且v(正)>v(逆),平衡正向移动;t4~t5段正逆速率都加快,且v(正)<v(逆),平衡逆向移动;该反应为体积减小的放热反应,若升高温度,平衡逆向移动,若增大压强,平衡正向移动,所以t2~t3段为增大压强,t4~t5段为升高温度;t2~t3段为增大压强后,平衡正向移动,SO3的含量升高,至t3~t4平衡时含量达最高;
故答案为:升高温度;t3~t4;
(5)由(4)的分析可知t2~t3段为增大压强,则K2=K1;t4~t5段为升高温度,则K3<K2;所以K4=K3<K2=K1;
故答案为:K4=K3<K2=K1.
故答案为:S(s)+O2(g)═SO2(g)△H=-297 KJ?mol-1;
(2)恒温恒容时,开始为1molSO2和2molO2 与开始为1molSO2和1molO2 相比,增大氧气的浓度,平衡正向移动,所以开始为1molSO2和2molO2 的SO2转化率高,放出热量的数值比|△H2|大;
故答案为:大;
(3)反应最后得到硫酸钠,根据钠原子、硫原子原子守恒,n(NaOH)=2n(S)=2×(0.2+0.8)mol=2mol.
若发生氧化还原反应,则是SO2被O2氧化,离子方程式为2SO2+O2+4OH-═2SO42-+2H2O.
故答案为:2mol;2SO2+O2+4OH-═2SO42-+2H2O;
(4)t2~t3段正逆速率都加快,且v(正)>v(逆),平衡正向移动;t4~t5段正逆速率都加快,且v(正)<v(逆),平衡逆向移动;该反应为体积减小的放热反应,若升高温度,平衡逆向移动,若增大压强,平衡正向移动,所以t2~t3段为增大压强,t4~t5段为升高温度;t2~t3段为增大压强后,平衡正向移动,SO3的含量升高,至t3~t4平衡时含量达最高;
故答案为:升高温度;t3~t4;
(5)由(4)的分析可知t2~t3段为增大压强,则K2=K1;t4~t5段为升高温度,则K3<K2;所以K4=K3<K2=K1;
故答案为:K4=K3<K2=K1.
点评:本题考查了热化学方程式、化学平衡等,综合性高,难度大,关键在于读图获取信息,培养学生分析问题解决问题能力.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
2010年11月6日,中央电视台《经济半小时》节目播放了有关氢化油和反式脂肪酸的内容,引起全国民众的持续关注,下列有关说法不正确的是( )
| A、反式脂肪酸甘油酯不能使酸性高锰酸钾溶液褪色 | B、油脂是人类的营养物质之一,进入人体后,在胃中水解产生高级脂肪酸和甘油 | C、天然动物脂肪中不含反式脂肪酸,可大量食用 | D、脂肪酸甘油酯顺式变反式,主要是在氢化过程中产生的变化 |
2013年7月23日,央视记者分别在北京崇文门附近的麦当劳、肯德基以及真功夫3家大型快餐店取回可食用冰块进行抽样检测.检测结果显示:3家快餐店食用冰块菌落总数严重超标.下列说法正确的是( )
| A、肉毒杆菌有毒,可在其中加入硫酸铜使其变性后食用 | B、肉毒杆菌在体内水解生成的氨基酸不能成为人体重要的营养物质 | C、大肠杆菌分子中不一定含羧基和氨基 | D、出血性大肠杆菌和油脂均为能水解的高分子化合物 |
2013年7月,雨带北抬后,沿海大量提溴厂暂时停产,造成了不小经济损失.下列关于海水提溴错误的是( )
| A、Br2可用热空气吹出,其原因是Br2低温会化合 | B、Cl2氧化Br- 应在酸性条件下进行,目的是为了避免Br2歧化 | C、硫酸酸化生成NaBr、NaBrO3等的化学方程式是5NaBr+NaBrO3+3H2SO4→3Br2+3Na2SO4+3H2O | D、为了除去工业Br2中微量的Cl2,可向工业Br2中通入HBr |