��Ŀ����
 ����������Ҫ����Ƿ��������ȣ��������Ʒ����������������裮
����������Ҫ����Ƿ��������ȣ��������Ʒ����������������裮��1������ý��V2O5���ܼӿ�SO2���������ʣ��˹�����SO2����V2O5��Ӧ����V2O4���ù��̵Ļ�ѧ����ʽ�ɱ�ʾΪ
SO2+V2O5?V2O4+SO3
SO2+V2O5?V2O4+SO3
����2��Ϊ�ⶨ�����л������SO2���������ѡ��0.0500mol/LI2�ı���Һ��������Һ���вⶨ����֪��V������I2����Һ��=10.00mL��V���ɼ�������=100.0mL��������Ϊ��״��������������SO2���������Ϊ
0.112
0.112
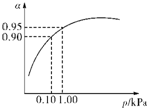
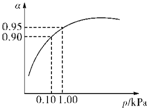
����3��һ���¶�ʱ��SO2��ƽ��ת���ʣ���������ϵ��ѹǿ��p���Ĺ�ϵ��ͼ��ʾ���Է�����ҵ�����в��ó�ѹ��ԭ����
�ڳ�ѹʱ��SO2��ת�����Ѻܸߣ�����ѹ������豸����Դ���нϸߵ�Ҫ�����ϲ�����
�ڳ�ѹʱ��SO2��ת�����Ѻܸߣ�����ѹ������豸����Դ���нϸߵ�Ҫ�����ϲ�����
����4�����¶���ͬ�������Ϊ1L�������ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ���й��������£�
��֪��2SO2��g��+O2��g��?2SO3��g������H=-98.3kJ?mol-1��
| ���� | �� | �� | �� |
| ��Ӧ��Ͷ���� | 2molSO2��1molO2 | 2molSO3 | mmolSO2��nmolO2��pmolSO3 |
| c��SO3��/mol?L-1 | 1.4 | 1.4 | 1.4 |
| �����仯 | �ų�akJ | ����bkJ | ����ckJ |
| SO2��SO3��ת���� | ��1 | ��2 | 12.5% |
1
1
��p=1.6
1.6
mol��b+c=39.32
39.32
kJ����������1�����ݷ���ý��V2O5���ܼӿ�SO2���������ʣ��˹�����SO2����V2O5��Ӧ����V2O4���ɿ�����Ԫ�صĻ��ϼ۴�+5�۽�Ϊ+4�ۣ����ԣ����������е����+4������Ϊ+5�ۣ�
��2���ⵥ�ʾ��������ԣ�����������+4�۵�����л�ԭ�ԣ�������Ӧ��SO2+I2+2H2O=H2SO4+2HI��
��3����ͼ���п��Կ�������ѹǿΪ0.1KPaʱ��SO2��ת����Ϊ0.90����ѹǿΪ1.0KPaʱ��SO2��ת����Ϊ0.95��
��4��2SO2��g��+O2��g��?2SO3��g������H=-98.3kJ?mol-1���÷�ӦΪ���ȷ�Ӧ�����¡����ݣ��ų��������Լ�ת������μӷ�Ӧ�����ʵ����ʵ��������ȣ�
��2���ⵥ�ʾ��������ԣ�����������+4�۵�����л�ԭ�ԣ�������Ӧ��SO2+I2+2H2O=H2SO4+2HI��
��3����ͼ���п��Կ�������ѹǿΪ0.1KPaʱ��SO2��ת����Ϊ0.90����ѹǿΪ1.0KPaʱ��SO2��ת����Ϊ0.95��
��4��2SO2��g��+O2��g��?2SO3��g������H=-98.3kJ?mol-1���÷�ӦΪ���ȷ�Ӧ�����¡����ݣ��ų��������Լ�ת������μӷ�Ӧ�����ʵ����ʵ��������ȣ�
����⣺��1��SO2����V2O5��Ӧ����V2O4��V2O5���뷴Ӧ������������������ԭΪV2O4�������������Ϊ��������
�ʴ�Ϊ��SO2+V2O5?V2O4+SO3��
��2�����ݹ�ʽn=c��v��I2�����ʵ���Ϊn=0.0500mol/L��0.01L=5��10-4mol�����ݷ�Ӧ��
SO2 +I2 +2H2O=H2SO4+2HI
5��10-4mol 5��10-4mol
��״���µ����Ϊ5��10-4mol��22.4L/mol=1.12��10-2L��V���ɼ�������=100.0mL��������Ϊ��״��������������SO2���������Ϊ
=0.112���ʴ�Ϊ��0.112��
��3����ѹǿΪ0.1KPaʱ��SO2��ת����Ϊ0.90��SO2��ת�����Ѻܸߣ���ѹǿΪ1.0KPaʱ��SO2��ת����Ϊ0.95��
��ʱ�����豸����Դ���кܸߵ�Ҫ��ѹǿ����������SO2ת���ʵı仯�������ԣ������ϲ����㣬
�ʴ�Ϊ���ڳ�ѹʱ��SO2��ת�����Ѻܸߣ�����ѹ������豸����Դ���нϸߵ�Ҫ�����ϲ����㣻
��4�����¶���ͬ�������Ϊ1L�������ܱ������У�SO3�����ʵ�����Ϊ1mol����ѧƽ��״̬�Ĵﵽ�뻯ѧ��Ӧ;���أ�����ͬ�������£����淴Ӧ�����۴�����Ӧ��ʼ���Ǵ��淴Ӧ��ʼ�����ǴӼ��з�Ӧ�����������↑ʼ���ﵽ�Ļ�ѧƽ��״̬����ͬ�ģ�ƽ�������и�������ʵİٷֺ������ֲ��䣬���ǵ�Чƽ�⣮�����ܱ����������ֺ��¡����ݣ�����c��SO3��=1.4 mol?L-1�����������еķ�ӦΪ��Чƽ�⣮�����Ϊ1L������n��SO3��=1.4 mol��
�� 2SO2��g��+O2��g��?2SO3��g������H=-98.3kJ?mol-1��
��ʼ����mol�� 2 1 0
�仯�� ��mol�� 1.4 0.7 1.4-98.3kJ��
=68.81KJ
ƽ���� ��mol�� 0.6 0.3
��a=68.81����1=
=0.7��
���������ֺ��¡����ݣ��ͼ������з�ӦΪ��Чƽ�⣮��b=98.3kJ����2-1.4��/2=29.49kJ���÷�Ӧ����������ʼ����2=
=0.3����1+��2=0.7+0.3=1��
�� 2SO2��g��+O2��g��?2SO3��g������H=-98.3kJ?mol-1������ckJ˵����Ӧ���淴Ӧ����ʼ��
��ʼ����mol�� m n p
�仯�� ��mol�� 0.2 0.1 1.4�£�1-12.5%��-1.4
ƽ���� ��mol�� m+0.2 n+0.1 1.4
P=1.4�£�1-12.5%��=1.6��c=98.3kJ����1.6-1.4��/2=9.83
b+c=29.49+9.83=39.32kJ��
�ʴ�Ϊ��1��1.6��39.32��
�ʴ�Ϊ��SO2+V2O5?V2O4+SO3��
��2�����ݹ�ʽn=c��v��I2�����ʵ���Ϊn=0.0500mol/L��0.01L=5��10-4mol�����ݷ�Ӧ��
SO2 +I2 +2H2O=H2SO4+2HI
5��10-4mol 5��10-4mol
��״���µ����Ϊ5��10-4mol��22.4L/mol=1.12��10-2L��V���ɼ�������=100.0mL��������Ϊ��״��������������SO2���������Ϊ
| 0.0112L |
| 0.1L |
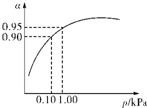
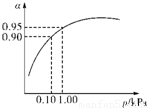
��3����ѹǿΪ0.1KPaʱ��SO2��ת����Ϊ0.90��SO2��ת�����Ѻܸߣ���ѹǿΪ1.0KPaʱ��SO2��ת����Ϊ0.95��
��ʱ�����豸����Դ���кܸߵ�Ҫ��ѹǿ����������SO2ת���ʵı仯�������ԣ������ϲ����㣬
�ʴ�Ϊ���ڳ�ѹʱ��SO2��ת�����Ѻܸߣ�����ѹ������豸����Դ���нϸߵ�Ҫ�����ϲ����㣻
��4�����¶���ͬ�������Ϊ1L�������ܱ������У�SO3�����ʵ�����Ϊ1mol����ѧƽ��״̬�Ĵﵽ�뻯ѧ��Ӧ;���أ�����ͬ�������£����淴Ӧ�����۴�����Ӧ��ʼ���Ǵ��淴Ӧ��ʼ�����ǴӼ��з�Ӧ�����������↑ʼ���ﵽ�Ļ�ѧƽ��״̬����ͬ�ģ�ƽ�������и�������ʵİٷֺ������ֲ��䣬���ǵ�Чƽ�⣮�����ܱ����������ֺ��¡����ݣ�����c��SO3��=1.4 mol?L-1�����������еķ�ӦΪ��Чƽ�⣮�����Ϊ1L������n��SO3��=1.4 mol��
�� 2SO2��g��+O2��g��?2SO3��g������H=-98.3kJ?mol-1��
��ʼ����mol�� 2 1 0
�仯�� ��mol�� 1.4 0.7 1.4-98.3kJ��
| 1.4 |
| 2 |
ƽ���� ��mol�� 0.6 0.3
��a=68.81����1=
| 1.4 |
| 2 |
���������ֺ��¡����ݣ��ͼ������з�ӦΪ��Чƽ�⣮��b=98.3kJ����2-1.4��/2=29.49kJ���÷�Ӧ����������ʼ����2=
| 2-1.4 |
| 2 |
�� 2SO2��g��+O2��g��?2SO3��g������H=-98.3kJ?mol-1������ckJ˵����Ӧ���淴Ӧ����ʼ��
��ʼ����mol�� m n p
�仯�� ��mol�� 0.2 0.1 1.4�£�1-12.5%��-1.4
ƽ���� ��mol�� m+0.2 n+0.1 1.4
P=1.4�£�1-12.5%��=1.6��c=98.3kJ����1.6-1.4��/2=9.83
b+c=29.49+9.83=39.32kJ��
�ʴ�Ϊ��1��1.6��39.32��
���������⿼��������Ĺ�ҵ��ȡ������ԭ��Ӧ�ã�����ʱ��ע��������Ϣ�����жϺ���д��ѧ����ʽ����������ջ�ѧƽ��ļ���Ļ���������

��ϰ��ϵ�д�
 ��ʱѵ���������������ϵ�д�
��ʱѵ���������������ϵ�д�
�����Ŀ
 ����������Ҫ����Ƿ��������ȣ��������Ʒ����������������裮
����������Ҫ����Ƿ��������ȣ��������Ʒ����������������裮
��1������ý��V2O5���ܼӿ�SO2���������ʣ��˹�����SO2����V2O5��Ӧ����V2O4���ù��̵Ļ�ѧ����ʽ�ɱ�ʾΪ______��
��2��Ϊ�ⶨ�����л������SO2���������ѡ��0.0500mol/LI2�ı���Һ��������Һ���вⶨ����֪��V������I2����Һ��=10.00mL��V���ɼ�������=100.0mL��������Ϊ��״��������������SO2���������Ϊ______��
��3��һ���¶�ʱ��SO2��ƽ��ת���ʣ���������ϵ��ѹǿ��p���Ĺ�ϵ��ͼ��ʾ���Է�����ҵ�����в��ó�ѹ��ԭ����______��
��4�����¶���ͬ�������Ϊ1L�������ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ���й��������£�
��֪��2SO2��g��+O2��g��?2SO3��g������H=-98.3kJ?mol-1��
| ���� | �� | �� | �� |
| ��Ӧ��Ͷ���� | 2molSO2��1molO2 | 2molSO3 | mmolSO2��nmolO2��pmolSO3 |
| c��SO3��/mol?L-1 | 1.4 | 1.4 | 1.4 |
| �����仯 | �ų�akJ | ����bkJ | ����ckJ |
| SO2��SO3��ת���� | ��1 | ��2 | 12.5% |
����������Ҫ����Ƿ��������ȣ��������Ʒ����������������裮
��1������ý��V2O5���ܼӿ�SO2���������ʣ��˹�����SO2����V2O5��Ӧ����V2O4���ù��̵Ļ�ѧ����ʽ�ɱ�ʾΪ______��
��2��Ϊ�ⶨ�����л������SO2���������ѡ��0.0500mol/LI2�ı���Һ��������Һ���вⶨ����֪��V������I2����Һ��=10.00mL��V���ɼ�������=100.0mL��������Ϊ��״��������������SO2���������Ϊ______��
��3��һ���¶�ʱ��SO2��ƽ��ת���ʣ���������ϵ��ѹǿ��p���Ĺ�ϵ��ͼ��ʾ���Է�����ҵ�����в��ó�ѹ��ԭ����______��
��4�����¶���ͬ�������Ϊ1L�������ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ���й��������£�
��֪��2SO2��g��+O2��g��?2SO3��g������H=-98.3kJ?mol-1��
���1+��2=______��p=______mol��b+c=______kJ��
��1������ý��V2O5���ܼӿ�SO2���������ʣ��˹�����SO2����V2O5��Ӧ����V2O4���ù��̵Ļ�ѧ����ʽ�ɱ�ʾΪ______��
��2��Ϊ�ⶨ�����л������SO2���������ѡ��0.0500mol/LI2�ı���Һ��������Һ���вⶨ����֪��V������I2����Һ��=10.00mL��V���ɼ�������=100.0mL��������Ϊ��״��������������SO2���������Ϊ______��
��3��һ���¶�ʱ��SO2��ƽ��ת���ʣ���������ϵ��ѹǿ��p���Ĺ�ϵ��ͼ��ʾ���Է�����ҵ�����в��ó�ѹ��ԭ����______��
��4�����¶���ͬ�������Ϊ1L�������ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ���й��������£�
��֪��2SO2��g��+O2��g��?2SO3��g������H=-98.3kJ?mol-1��
| ���� | �� | �� | �� |
| ��Ӧ��Ͷ���� | 2molSO2��1molO2 | 2molSO3 | mmolSO2��nmolO2��pmolSO3 |
| c��SO3��/mol?L-1 | 1.4 | 1.4 | 1.4 |
| �����仯 | �ų�akJ | ����bkJ | ����ckJ |
| SO2��SO3��ת���� | ��1 | ��2 | 12.5% |