��Ŀ����
��֪��2SO2��g��+O2��g��?2SO3��g����H=-197kJ?mol-1�����ݻ���ͬ�ļס��ҡ������������У������¶ȡ��ݻ�һ�����ֱ��±�Ҫ��������巢����Ӧ��
�����������ݣ����бȽ���ȷ���ǣ�������
| ���� | SO2��mol�� | O2��mol�� | ������mol�� | ��ƽ��ʱʵ����ЧӦ��kJ?mol-1�� |
| �� | 2 | 1 | 0 | ��Hl |
| �� | 1 | 0.5 | 0 | ��H2 |
| �� | 1 | 0.5 | 1 | ��H3 |
| A����Hl=-197 kJ?mol-1 |
| B����H2=��H3 |
| C����Hl=2��H2 |
| D����Hl����H3 |
��������ӦΪ���淴Ӧ��Ũ�Ȳ�ͬ��ƽ��ת���ij̶Ȳ��ȣ�������ƽ���ƶ�û��Ӱ�죬
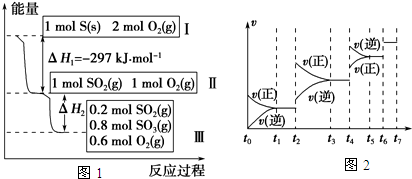
����⣺��Ӧ���Ȼ�ѧ����ʽΪ��2SO2��g��+O2��g�� 2SO3��g������H=-197kJ/mol��
2SO3��g������H=-197kJ/mol��
A�����Ȼ�ѧ����ʽ��֪�������������·�Ӧ����1molSO3�������197kJ������2mol���������1mol����������ȫת�������ԡ�Hl��-197 kJ?mol-1����A����
B����������������£����뵪����ƽ���ƶ�û��Ӱ�죬���H2=��H3����B��ȷ��
C������װ�öԱȣ���Ͷ�����ӣ��൱�����ҵĻ���������ѹǿ����ѧƽ�������ƶ����ŵ����������࣬���ԡ�Hl��2��H2����C����
D����������������£����뵪����ƽ���ƶ�û��Ӱ�죬���H2=��H3����C�Ľ��ͣ���Hl��2��H2�����ԡ�Hl��2��H3����D����
��ѡB��
 2SO3��g������H=-197kJ/mol��
2SO3��g������H=-197kJ/mol��A�����Ȼ�ѧ����ʽ��֪�������������·�Ӧ����1molSO3�������197kJ������2mol���������1mol����������ȫת�������ԡ�Hl��-197 kJ?mol-1����A����
B����������������£����뵪����ƽ���ƶ�û��Ӱ�죬���H2=��H3����B��ȷ��
C������װ�öԱȣ���Ͷ�����ӣ��൱�����ҵĻ���������ѹǿ����ѧƽ�������ƶ����ŵ����������࣬���ԡ�Hl��2��H2����C����
D����������������£����뵪����ƽ���ƶ�û��Ӱ�죬���H2=��H3����C�Ľ��ͣ���Hl��2��H2�����ԡ�Hl��2��H3����D����
��ѡB��
���������⿼�鷴Ӧ�ȵļ��㣬��Ŀ�Ѷ��еȣ�����ע��Ũ�ȶ�ƽ���Ӱ���Լ����淴Ӧ��������

��ϰ��ϵ�д�
 �Ǽ�����������ϵ�д�
�Ǽ�����������ϵ�д� â���̸������Ծ�ϵ�д�
â���̸������Ծ�ϵ�д�
�����Ŀ
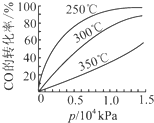 �о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���壮
�о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���壮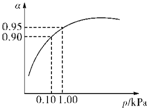 ����������Ҫ����Ƿ��������ȣ��������Ʒ����������������裮
����������Ҫ����Ƿ��������ȣ��������Ʒ����������������裮 2SO3��g������H=-197kJ/mol��ʵ����ij������4molSO2����������Ӧʱ�ų�275.8kJ��������SO2��ת���ʣ������ĵ�SO2ռԭ��SO2�İٷֱȣ�Ϊ
2SO3��g������H=-197kJ/mol��ʵ����ij������4molSO2����������Ӧʱ�ų�275.8kJ��������SO2��ת���ʣ������ĵ�SO2ռԭ��SO2�İٷֱȣ�Ϊ