题目内容
18.下列各表述与下图所示一致的是( )| A. | 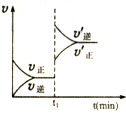 表示某吸热反应t1时刻升高温度时,正逆反应速率的变: | |
| B. | 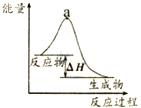 表示某放热反应过程的能量变化,若使用催化剂,a点会降低 | |
| C. | 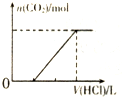 表示向含等物质的量的NaOH、Na2CO3混合溶液中滴加0.1 mol•L-1盐酸至过量时,产生气体的体积与消耗盐酸的关系 | |
| D. | 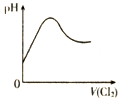 表示Cl2通入H2SO3溶液中pH的变化 |
分析 A.升高温度,正逆反应速率都增大,平衡向吸热反应方向移动;
B、催化剂可以降低反应的活化能,从而加快化学反应的速率;
C、向含等物质的量的NaOH、Na2CO3混合溶液中滴加0.1 mol•L-1盐酸至过量时,先发生反应NaOH+HCl═NaCl+H2O,再滴加稀盐酸发生反应Na2CO3+HCl=NaCl+NaHCO3,最后滴加稀盐酸再发生反应NaHCO3+HCl=NaCl+CO2↑+H2O;
D、H2SO3溶液呈酸性,具有还原性,Cl2具有强氧化性通入H2SO3溶液中将被H2SO3氧化生成硫酸,溶液酸性增强,pH减小.
解答 解:A.升高温度,正逆反应速率都增大,平衡向吸热反应方向移动即正反应方向移动,所以升高温度后正反应速率应大于逆反应速率,故A错误;
B、反应物的总能量大于生成物的总能量,则反应是放热反应,加入催化剂会降低活化能,但反应热不改变,所以a点会降低,故B正确;
C、向含等物质的量的NaOH、Na2CO3混合溶液中滴加0.1 mol•L-1盐酸至过量时,先发生反应NaOH+HCl═NaCl+H2O,再滴加稀盐酸发生反应Na2CO3+HCl=NaCl+NaHCO3,最后滴加稀盐酸再发生反应NaHCO3+HCl=NaCl+CO2↑+H2O,所以先没有气体生成,当氢氧化钠消耗完,碳酸钠也完全转化为碳酸氢钠后,再滴加稀盐酸才能生成二氧化碳,且三次盐酸的体积之比为1:1:1,故C错误;
D、H2SO3溶液呈酸性,具有还原性,Cl2具有强氧化性通入H2SO3溶液中将被H2SO3氧化生成硫酸,反应方程式为:Cl2+H2SO3+H2O═H2SO4+2HCl,所以溶液酸性增强,pH应该减小,故D错误.
故选B.
点评 本题考查了图象分析,明确物质的性质及物质反应先后顺序是解本题关键,注意C选项碳酸钠和盐酸分两步反应,为易错点,难度一般.

| A. |  钾的燃烧实验 | B. |  用强碱滴定强酸 | ||
| C. |  铁与H2O(g)反应 | D. |  探究温度对平衡移动的影响 |

| A. | 碘元素的质子数为53 | |
| B. | 碘原子的质量数为126.9 | |
| C. | 碘原子核外有5种不同能量的电子 | |
| D. | 碘原子最外层有7种不同运动状态的电子 |
| A. | 测定某二元弱酸钠盐溶液的pH,可能小于7 | |
| B. | 稀释0.1mol/LCH3COOH(aq),$\frac{c(O{H}^{-})c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$可能变大也可能变小 | |
| C. | 在20.00ml浓度均为0.100 mol/L的HCl与CH3COOH混合溶液中滴加0.200mol/LNaOH溶液至pH=7,NaOH溶液体积一定小于20.00ml | |
| D. | pH=8的碱性溶液中一定没有CH3COOH分子 |
| A. | 为防止富脂食品氧化变质,常在包装袋中放入生石灰 | |
| B. | 铬是人体必需的微量元素,但铬过量会危害人体健康,其中六价铬的毒性最大.人体内六价铬超标,可以服用维生素C缓解毒性,说明维生素C具有氧化性 | |
| C. | 去年冬天的雾霾天气严重影响了人们的正常出行和生活节奏.为改善空气质量,可以加高工厂的烟囱,使烟尘和废气远离地表 | |
| D. | 硅酸钠是最简单的硅酸盐,是制备硅胶和木材防火剂的原料 |
| A. | 用 pH 试纸检验气体,一般先将 pH试纸用蒸馏水湿润,粘在玻璃棒的一端,并使其接近出气口,观察颜色的变化 | |
| B. | 检验 Fe3O4中是否含+2价铁元素时,先用盐酸溶解Fe3O4,再用 KMnO4溶液检验 | |
| C. | 海带中碘元素的提取和检验实验中为制取海带灰的浸取液,需要煮沸1-2min,其主要目的是赶走溶液中的溶解氧,避免氧气氧化碘离子 | |
| D. | 检验麦芽糖水解的产物时,先向水解后的溶液中加入氢氧化钠溶液至碱性,再加入新制的银氨溶液并水浴加热 |
| A. | 该反应中氢气做还原剂,铝做氧化剂 | |
| B. | 在空气中Al2O3比 B2H6更稳定 | |
| C. | B2H6中存在极性键、非极性键、离子键 | |
| D. | 每生成1mol B2H6要消耗2molAlCl3 |
| A. | 丙烷与甲烷互为同系物 | |
| B. | 通常条件下,丙烷性质稳定,不与酸、碱和氧化剂发生反应 | |
| C. | 丙烷燃烧是吸热反应 | |
| D. | 火炬燃料用丙烷比用煤油更环保 |
| A. | Si 1s22s22p2 | B. | O2- 1s22s22p6 | ||
| C. | Na+ 1s22s22p6 | D. | Al 1s22s22p63s23p1 |