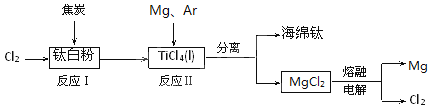
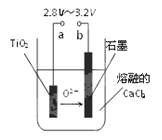
题目内容
【题目】锂—磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:2Na3PO4+4CuSO4+2NH3·H2O===Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)与NH3互为等电子体的分子、离子有________、________(各举一例)。
(2)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则1 mol CN-中含有的π键的数目为________;若此离子与[Cu(H2O)4]2+结构相似,则此离子的空间构型为 。
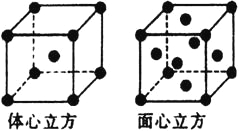
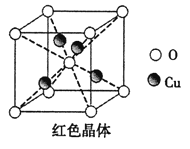
(3)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如图所示。则该化合物的化学式为________。
(4) 甲醛(H2C=O)在Ni催化作用下加氢可得甲醇(CH3OH)。甲醇分子内的O-C-H键角________(填“大于”、“等于”或“小于”)甲醛分子内的O-C-H键角;甲醇易溶于水的原因是 。
(5) 金属酞菁配合物在硅太阳能电池中有重要作用,一种金属镁酞菁配合物的结构如图所示,其中N原子的杂化方式为 ,在如图的方框内请在图中用箭头表示出配位键。
【答案】(1)PH3、H3O+
(2)2NA 平面正方形
(3)CuH
(4)小于 甲醇分子和水分子间能够形成氢键,且甲醇和水都是极性分子,相似相溶。
(5)sp2、sp3 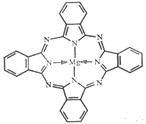
【解析】试题分析:(1)原子数和价电子数分别都相等的是等电子体,则与NH3互为等电子体的分子、离子有PH3、H3O+;
(2)一个 CN-中含有2个π键,所以1mol CN-中含有的π键的数目为:2NA,若此配离子[Cu(H2O)4]2+是正四面体结构,此配离子与[Cu(H2O)4]2+结构相似,则此配离子的空间构型为平面正方形;
(3)该晶胞中,铜原子个数=4+2×![]() +12×
+12×![]() =7,H原子个数=1+3+6×
=7,H原子个数=1+3+6×![]() =7,所以其化学式为CuH;
=7,所以其化学式为CuH;
(4)甲醇分子内C的成键电子对数为4,无孤电子对,杂化类型为sp3,是四面体结构,甲醛分子中的碳采取sp2杂化,是平面三角形结构,甲醇分子内O﹣C﹣H键角比甲醛分子内O﹣C﹣H键角小;由于甲醇分子和水分子间能够形成氢键,且甲醇和水都是极性分子,相似相溶,所以甲醇易溶于水。
(5)根据示意图可判断形成双键的氮原子是sp2杂化,全部形成单键的是sp3杂化;配位键由提供孤电子对的原子指向提供空轨道的原子,其中Mg提供空轨道,所以该配合物中的配位键可表示为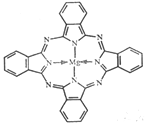 。
。