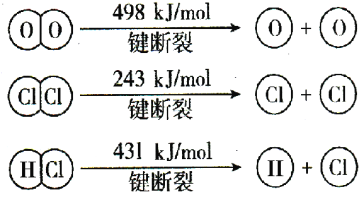
题目内容
【题目】[化学 选修2:化学与技术]
铵盐是重要的化工原料,以N2和H2为原料制取硝酸铵的流程图如下,请回答下列问题:

(1)在上述流程图中,B设备的名称是 ,其中发生反应的化学方程式为 。
(2)在上述工业生产中,N2与H2合成NH3的催化剂是 。1909年化学家哈伯在实验室首次合成了氨,2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:

![]() 分别表示N2、H2、NH3 。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是 、 。
分别表示N2、H2、NH3 。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是 、 。

(3)NH3和CO2在一定条件下可合成尿素,其反应为:2NH3(g)+CO2(g) ![]() CO( NH2)2(s)+H2O(g)
CO( NH2)2(s)+H2O(g)
右图表示合成塔中氨碳比a与CO2转化率ω的关系。a为[n(NH3)/n(CO2)],b为水碳比[n(H2O)/n(CO2)]。则:
①b应控制在 ; A.1.5.1.6 B.1~1.1 C.0.6~0.7
②a应控制在4.0的理由是 。
(4)在合成氨的设备(合成塔)中,设置热交换器的目的是 ;在合成硝酸的吸收塔中通入空气的目的是 。
(5)生产硝酸的过程中常会产生一些氮的氧化物,可用如下两种方法处理:
碱液吸收法:NO+NO2+2NaOH=2NaNO2+H2O
NH3还原法:8NH3+6NO2![]() 7N2+12H2O(NO也有类似的反应)
7N2+12H2O(NO也有类似的反应)
以上两种方法中,符合绿色化学的是 。
(6)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗NH3质量(不考虑其它损耗)的 %。
【答案】(1)氧化炉 ![]()
(2)铁砂网(或铁) N2、H2被吸附在催化剂表面; 在催化剂表面,N2、H2中化学键断裂
(3)①C ②a等于4.0,CO2转化率迅速提高到最大值,而a在4.0之后增大,c(NH3)转化率无明显增大。
(4)利用余热,节约能源;可使NO循环利用,全部转化成HNO3
(5)NH3还原法
(6)53
【解析】
试题分析:(1)在上述工业制硝酸的生产中,B设备是进行氨的催化氧化反应,在氧化炉中进行;发生反应的方程式为:4NH3+5O2![]() 4NO+6H2O;(2)在上述工业生产中,N2与H2合成NH3的催化剂是铁砂网氮;氮气气、氢气在催化剂表面合成氨反应过程的顺序为:图①氮气分子和氢气分子向催化剂表面靠近,图②氮气和氢气吸附在催化剂的表面,图③在催化剂的作用下分解成氢原子和氮原子,图④表示氮原子与氢原子重新结合成氨分子,图⑤生成的氨气离开催化剂表面,故答案为:铁砂网;N2、H2被吸附在催化剂表面;在催化剂表面,N2、H2中化学键断裂;(3)①由图可知,水碳比[n(H2O):n(CO2)]b的值越小,则CO2转化率ω越大,故b应控制在0.6~0.7,故选C;②a控制在4.0时,CO2转化率ω已经达到较高的值,而继续提高氨碳比[n(NH3):n(CO2)],CO2转化率ω无明显提高,故控制在4.0,故答案为:a等于4.0,CO2转化率迅速提高到最大值;而a在4.0之后增大,CO2转化率无明显增大;
4NO+6H2O;(2)在上述工业生产中,N2与H2合成NH3的催化剂是铁砂网氮;氮气气、氢气在催化剂表面合成氨反应过程的顺序为:图①氮气分子和氢气分子向催化剂表面靠近,图②氮气和氢气吸附在催化剂的表面,图③在催化剂的作用下分解成氢原子和氮原子,图④表示氮原子与氢原子重新结合成氨分子,图⑤生成的氨气离开催化剂表面,故答案为:铁砂网;N2、H2被吸附在催化剂表面;在催化剂表面,N2、H2中化学键断裂;(3)①由图可知,水碳比[n(H2O):n(CO2)]b的值越小,则CO2转化率ω越大,故b应控制在0.6~0.7,故选C;②a控制在4.0时,CO2转化率ω已经达到较高的值,而继续提高氨碳比[n(NH3):n(CO2)],CO2转化率ω无明显提高,故控制在4.0,故答案为:a等于4.0,CO2转化率迅速提高到最大值;而a在4.0之后增大,CO2转化率无明显增大;
(4)合成氨的反应属于放热反应,反应过程中会放出大量的热,用热交换器可以充分利用余热,节约能源;在吸收塔中二氧化氮与水反应生成硝酸和NO,通入空气,NO能被空气中的氧气氧化为二氧化氮,二氧化氮再与水反应生成硝酸,这样使NO循环利用,全部转化为硝酸;故答案为:利用余热,节约能源;可使NO循环利用,全部转化成HNO3;(5)碱液吸收法:NO+NO2+2NaOH═2NaNO2+H2O,NH3还原法:8NH3+6NO2![]() 7N2+12H2O,分析可知碱液吸收法消耗大量的氢氧化钠生成的亚硝酸盐毒,NH3还原法产物无污染,得到合成氨的原料气,故符合绿色化学的是氨气还原法,故答案为:NH3还原法;(6)根据氮原子守恒可知,NH3~NO~HNO3,则1mol氨气可得到硝酸的物质的量为:1mol×96%×92%=0.8832mol,根据HNO3+NH3═NH4NO3可知反应消耗的氨气的物质的量为:0.8832mol,
7N2+12H2O,分析可知碱液吸收法消耗大量的氢氧化钠生成的亚硝酸盐毒,NH3还原法产物无污染,得到合成氨的原料气,故符合绿色化学的是氨气还原法,故答案为:NH3还原法;(6)根据氮原子守恒可知,NH3~NO~HNO3,则1mol氨气可得到硝酸的物质的量为:1mol×96%×92%=0.8832mol,根据HNO3+NH3═NH4NO3可知反应消耗的氨气的物质的量为:0.8832mol,
氨气的质量之比等于物质的量之比,则制HNO3所用去的NH3的质量占总耗NH3质量的百分数为:
1mol÷(1mol+0,8832mol)×100%≈53%.

【题目】某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:

沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 2.3 | 7.6 | 4.4 |
完全沉淀的pH | 3.2 | 9.7 | 6.4 |
(1)酸浸后加入H2O2的目的是 。调pH步骤中加入的试剂最好是 (填化学式)。实验室进行过滤操作所用到的玻璃仪器有 、 、 。
(2)煮沸CuSO4溶液的原因是 。向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式 。
(3)Fe3+发生水解反应Fe3++3H2O![]() Fe(OH)3+3H+,该反应的平衡常数表达式为 。
Fe(OH)3+3H+,该反应的平衡常数表达式为 。
(4)称取所制备的CuCl样品0.250 0 g置于一定量的0.5 mol·L-1FeCl3溶液中,待样品完全溶解后,加水20 mL,用0.100 0 mol·L-1的Ce(SO4)2溶液滴定,到达终点时消耗Ce(SO4)2溶液25.00 mL。有关的化学反应为Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+。计算该CuCl样品的质量分数 。